5月14日,复旦大学和同济大学研究团队在期刊《ADVANCED SCIENCE》上在线发表题为“Photosynthetic Bacteria-Hitchhiking 2D iMXene-mRNA Vaccine to Enable Photo-Immunogene Cancer Therapy”的研究论文,本研究为mRNA疫苗提供了一种新型递送纳米载体和治疗肿瘤的联合策略,为其在个体化肿瘤疫苗、其他疫苗应用和癌症治疗中的广泛应用铺平了道路。此外,研究人员的创新方法在mRNA纳米疫苗领域具有显著的潜力,可实现光免疫基因癌症治疗和其他肿瘤治疗的普遍应用。
研究背景
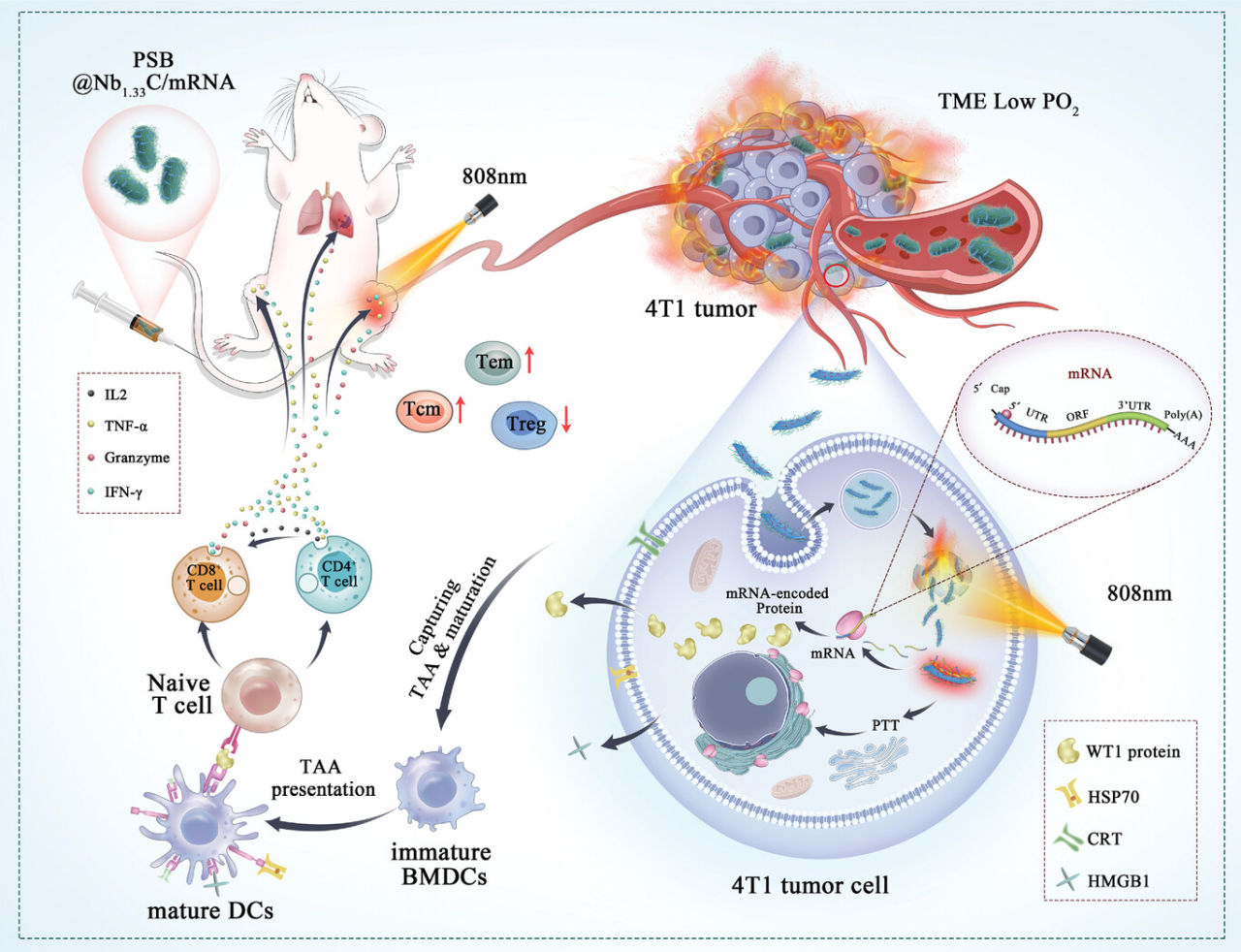
近年来,mRNA疫苗作为治疗肿瘤的有前景的治疗工具引起了广泛关注。mRNA 疫苗可以编码多种肿瘤相关抗原(TAA),细胞内的细胞内蛋白质翻译和抗原加工导致在抗原呈递细胞(APC)中与主要组织相容性复合物I(MHC I)形成复合物,主要是树突状细胞(DC),随后将抗原呈递给T细胞,从而触发强大的肿瘤特异性T细胞反应。肾母细胞瘤基因WT1参与不同类型癌症的发病机制。WT1蛋白自然参与调节癌症患者的体液和细胞免疫,这表明其免疫原性。因此,靶向WT1的癌症免疫疗法将是有价值的。然而,由于mRNA疫苗的生物不稳定性、分子量大、内在免疫原性高、体内递送不足等特点,其应用受到限制。因此,应克服这些限制,以改善mRNA疫苗的使用。
近几十年来,某些活微生物已被证明可以有效地将载药物质输送到肿瘤组织的缺氧区域,因为它们能够在光和磁存在下迁移或具有自动驱动性质。此外,某些微生物可以直接攻击癌细胞并充当治疗剂。活微生物已被用于在声动和光动力疗法中对抗肿瘤,兼性厌氧菌,如光合细菌(PSB),具有原始光能合成系统的特性。活的PSB在近红外(NIR)区域吸附光的能力使其能够充当光热剂,产生热量。光热和基因治疗的协同组合显示出治疗乳腺癌的巨大潜力。光热疗法(PTT)和基因疗法的协同组合可能用于治疗乳腺癌。利用其缺氧靶向和PTT特性的结合,PSB可以在没有任何修改的情况下实现缺氧靶向癌症治疗。因此,PSB可以用作靶向肿瘤部位的递送工具,并在近红外激光照射下作为光热治疗剂杀死肿瘤细胞,以增强免疫系统的激活。
研究发现
本研究旨在构建一种新型mRNA疫苗递送纳米系统,以成功共递送由肾母细胞瘤1(WT1)mRNA编码的肿瘤相关抗原(TAA)。在这个系统中,名为 PSB@Nb1.33C/mRNA,光合细菌(PSB)利用光驱动和缺氧驱动的特性将 iMXene-WT1 mRNA有效地递送至肿瘤核心区域。PSB和2D iMxene(Nb1.33C)的优异光热治疗(PTT)性能触发肿瘤免疫原性细胞死亡,从而促进WT1 mRNA的释放。释放的WT1 mRNA被翻译,呈现TAA并在体内放大免疫作用。所设计的治疗策略显示出抑制远处肿瘤和抵消术后肺转移的出色能力。因此,本研究为肿瘤免疫治疗(即光免疫基因癌症治疗)提供了创新有效的范式,为mRNA疫苗建立了高效的递送平台,从而为mRNA疫苗的广泛应用开辟了一条新途径。
研究结论
综上所述,本研究为mRNA疫苗提供了一种新型递送纳米载体和治疗肿瘤的联合策略,为其在个体化肿瘤疫苗、其他疫苗应用和癌症治疗中的广泛应用铺平了道路。此外,研究人员的创新方法在mRNA纳米疫苗领域具有显著的潜力,可实现光免疫基因癌症治疗和其他肿瘤治疗的普遍应用。
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202307225