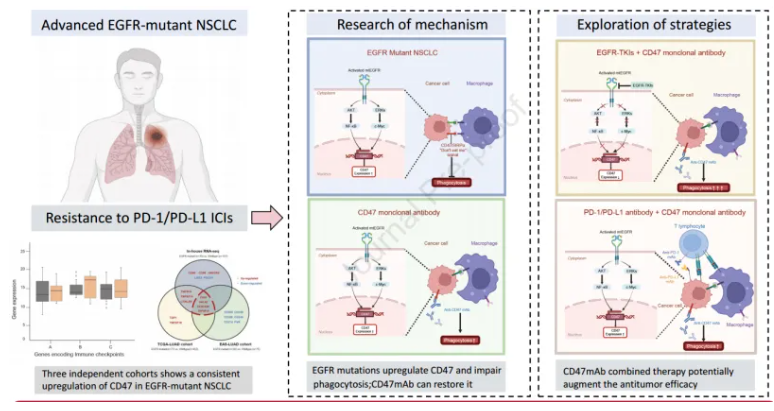
2024年3月27日,中山大学方文峰团队在Journal of Thoracic Oncology(IF=20)在线发表题为“EGFR Oncogenic Mutations in NSCLC Impair Macrophage Phagocytosis and Mediate Innate Immune Evasion Through Upregulation of CD4”的研究论文,该研究发现非小细胞肺癌中EGFR致癌突变损害巨噬细胞吞噬并通过上调CD47介导先天免疫逃逸。在所有筛选的免疫检查点中,CD47成为与EGFR激活最相关的候选点。在机制上,EGFR突变组成性激活下游ERK和AKT通路,分别上调转录因子c-Myc和NF-κB,这两种转录因子在结构上结合CD47的启动子区域,并主动转录这一“不要吃我”信号。
在非小细胞肺癌细胞系模型中,引入EGFR致敏突变后,发现巨噬细胞吞噬功能受损,而CD47阻断在体外和体内模型中均恢复了巨噬细胞的吞噬能力,增强了肿瘤细胞的杀伤能力。值得注意的是,在免疫功能正常或适应性免疫缺陷小鼠模型中,与单一抗肿瘤药物治疗相比,抗CD47抗体与EGFR TKI的联合治疗显示出附加的抗肿瘤活性。因此,EGFR致敏突变通过上调CD47促进NSCLC逃避先天免疫攻击。结合CD47阻断剂的联合治疗在开发更有效的治疗方法治疗EGFR突变型NSCLC的临床翻译中具有巨大的前景。
肺癌目前是癌症相关死亡的主要原因,预计未来几十年全球发病率将持续上升。肺腺癌(LUAD)是非小细胞肺癌(NSCLC)的主要组织学亚型,显示出显著的致癌驱动改变频率。在亚洲人群中,超过50%的LUAD病例携带表皮生长因子受体(EGFR)突变,在靶向治疗时代提供了显着的治疗优势。然而,对大多数患者来说,对EGFR酪氨酸激酶抑制剂(TKIs)的耐药性是不可避免的。
尽管快速发展的免疫检查点抑制剂(ICI)有望成为靶向治疗耐药后的一种治疗选择,但PD-1/PD-L1抑制剂在EGFR突变的非小细胞肺癌中明显缺乏疗效。近年来已经描述了各种影响抗PD-1/PD-L1疗效的因素,包括降低肿瘤突变负担(TMB)导致较低的新抗原水平,主要组织相容性复合体(MHC)下调导致免疫原性弱,肿瘤免疫微环境无炎症等。结合不同抗肿瘤机制的治疗方法是一个普遍原则,并且仍然是最大限度地杀死肿瘤的最有效策略。然而,尽管临床前研究显示出显著的协同作用,但在临床实践中,EGFRTKI联合PD-1/PD-L1阻断剂因严重的毒性而受到限制。因此,寻找新的EGFR突变型NSCLC的免疫治疗靶点,发挥免疫系统强大的抗肿瘤作用至关重要。
机理模式图(图源自Journal of Thoracic Oncology )
CD47是一种新的免疫检查点,它与信号调节蛋白α (SIRPα)相互作用,向先天免疫反应传递“不要吃我”的信号这种相互作用允许癌细胞逃避吞噬作用,并通过巨噬细胞,从而减少了适应性免疫反应的启动。CD47已被确定为NSCLC的一个预后逆转因子。也有报道称,高表达的CD47与EGFR TKI耐药相关,阻断CD47可增强奥西替尼在NSCLC中的抗肿瘤疗效,提示CD47与EGFR致癌突变之间存在潜在关联。
该研究通过筛选临床样本和NSCLC细胞系模型中的一组免疫检查点相关基因,证明CD47成为与EGFR激活最相关的候选基因。激活EGFR突变通过激活ERK/c-Myc和AKT/NF-κB通路,通过转录上调CD47的表达,从而损害癌细胞的巨噬细胞吞噬。阻断CD47可以通过利用先天免疫反应增强EGFRTKI的抗肿瘤功效。这种联合策略在开发针对EGFR突变型NSCLC的更有效治疗方法方面具有重要的临床转化前景。
原文链接:
https://www.jto.org/article/S1556-0864(24)00127-8/abstract