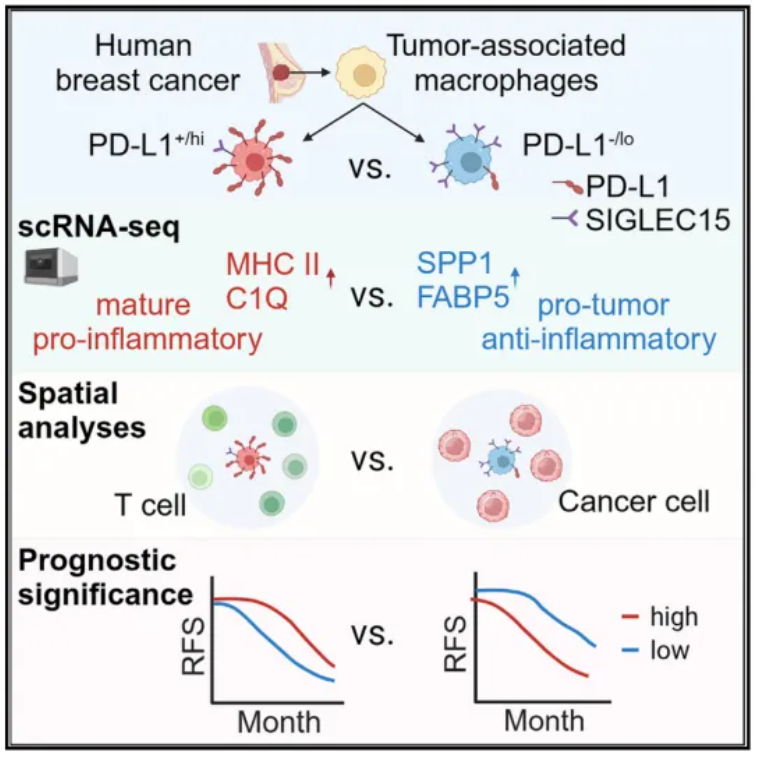
2024年3月20日,深圳大学王雷及希望之城国家医学中心 Peter P. Lee共同通讯在Cell Reports Medicine 在线发表题为“PD-L1-expressing tumor-associated macrophages are immunostimulatory and associate with good clinical outcome in human breast cancer”的研究论文,该研究通过单细胞转录组学和空间多重免疫荧光分析,发现PD-L1+ TAMs是成熟的,具有免疫刺激作用,对T细胞具有空间偏好。
相反,PD-L1 - TAMs具有免疫抑制作用,并与癌细胞在空间上共定位。在两个独立的乳腺癌患者队列中,较高的PD-L1+ TAMs密度或PD-L1+ /PDL1 - TAMs比例与良好的临床结果相关。在机制上,发现PD-L1在单核细胞向巨噬细胞的成熟和分化过程中上调,不需要外部IFN-γ刺激。功能上,PD-L1+ TAMs更成熟/活化,促进CD8+ T细胞增殖和细胞毒能力。总之,该研究揭示了PD-L1在时间内的免疫学意义。
程序性细胞死亡配体1 (Programmed cell death ligand 1, PD-L1)是PD-1的配体,它不仅可以在癌细胞中表达,也可以在肿瘤免疫微环境(TIME)内的骨髓细胞中表达。已经证实,表达PD-L1的癌细胞可以通过直接抑制PD-L1 + T细胞的细胞毒性而产生适应性免疫抵抗。最近的研究表明,肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是人体内主要表达PD-L1的细胞。PD-L1+ TAMs在人肿瘤中的生物学意义和功能作用尚不清楚。
基于小鼠肿瘤模型的机制研究表明,表达PD-L1的TAMs在抑制抗肿瘤免疫中发挥重要作用。然而,临床研究表明,在未经免疫治疗的肺癌、肝癌、乳腺癌(BC)患者中,表达PD-L1的TAMs与更好的总生存率相关。此外,在膀胱癌、尿路上皮癌或BC患者中,骨髓细胞表达PD-L1比癌细胞表达PD-L1更能预测PD-L1 /PD-L1阻断的反应。这些关于表达PD-L1的TAMs的对比发现提出了PD-L1表达在TAMs上的免疫调节功能意义的重要问题。
通过单细胞RNA测序(scRNA-seq)对人类TAMs进行转录组学分析,发现其异质性较高,但缺乏PD-L1的表达。这可能是由于PD-L1基因从scRNA-seq数据中缺失,因为它是一个低丰度的转录。利用scRNA-seq数据进行生物信息学模拟的研究报道,人类PD-L1+TAMs上调抗原呈递基因,可能对T细胞具有免疫抑制作用。另一方面,通过离体功能测定的研究报道,肺癌患者的PD-L1+ TAMs可能不会抑制自体肿瘤特异性T细胞的癌细胞杀伤能力,反映了人类PD-L1+ TAMs功能的不一致性。
机理模式图(图源自Cell Reports Medicine )
该研究揭示了PD-L1表达在人乳腺肿瘤TAMs中的功能和临床意义。scRNA-seq数据、细胞-细胞空间相互作用分析和离体功能分析的集体发现表明,PD-L1+ TAMs具有免疫刺激作用,而不是通常认为的免疫抑制作用。因此,它们的存在反映了免疫活性时间,并可能解释为什么它们预测抗pPD-1/PD-L1 (ICI)治疗的反应。需要进一步研究抗PD-1/PD-L1免疫疗法对体内PD-L1+ TAMs功能的影响。
王雷教授为第一/共同通讯作者,基础医学硕士研究生郭旨琨、团队成员余江南等参与该研究工作,深圳大学为第一完成单位。本研究得到国家自然科学基金、深圳市科创委基金以及深圳大学校内项目的资助。
原文链接:
https://doi.org/10.1016/j.xcrm.2024.101420