2024年2月24日,华东师范大学杜冰团队在Journal of Hematology & Oncology(IF=29)在线发表题为“FFAR2 expressing myeloid-derived suppressor cells drive cancer immunoevasion”的研究论文,该研究发现表达 FFAR2 的髓源性抑制细胞驱动癌症免疫逃逸。代谢物分析显示,患者和小鼠模型的肿瘤组织中都有显著的乙酸积累,乙酸通过游离脂肪酸受体2 (FFAR2)显著促进免疫抑制和癌症进展。此外,FFAR2在肺腺癌(LUAD)患者肿瘤的髓源性抑制细胞(MDSCs)中高度表达,这与预后不良密切相关。令人惊讶的是,整个或髓系Ffar2基因缺失显著抑制了乌拉坦诱导的肺癌发生和同系肿瘤生长,MDSCs减少,CD8+ T细胞浸润增加。
机制上,MDSCs中FFAR2缺失通过Gαq/Calcium/PPAR-γ轴显著降低Arg1的表达,从而通过缓解肿瘤微环境中L-精氨酸的消耗消除T细胞功能障碍。因此,补充L-精氨酸或抑制PPAR-γ可显著恢复醋酸/FFAR2介导的T细胞抑制。最后,FFAR2抑制通过增强肿瘤浸润性T细胞的募集和细胞毒性克服了免疫检查点阻断的抵抗。总之,该研究表明,乙酸/FFAR2轴通过Gαq/Calcium/PPAR-γ/Arg1信号通路增强MDSCs介导的免疫抑制,从而促进癌症进展。
造血干细胞(Hematopoietic stem cells, hsc)衍生的肿瘤浸润性骨髓细胞是肿瘤微环境中最丰富的异质免疫相关细胞,在肿瘤免疫逃避中发挥着重要作用。其中,髓源性抑制细胞(myeloid-derived suppressor cells, MDSCs)具有病理活化和极强的免疫抑制作用,与癌症患者临床预后差密切相关。新出现的研究表明,MDSCs有助于病理条件下骨髓细胞的多样性。然而,这种多样性的性质以及MDSCs与中性粒细胞和单核细胞的区别特征却知之甚少。
一般来说,MDSCs根据其强烈的表型和形态差异可分为粒细胞/多形核MDSCs (PMN-MDSCs)和单核细胞MDSCs (M-MDSCs)。实际上,复杂的病理环境导致MDSCs具有特定的基因组、蛋白质组学和代谢特征,从而使其具有对肿瘤逃避的特殊免疫抑制作用。因此,表征和探索不同比例的MDSCs的特征和功能对于靶向骨髓细胞改善当前的免疫治疗方案或克服免疫治疗耐药性至关重要。
肿瘤的发生和发展依赖于癌细胞的代谢重编程来满足其生物能量和生物合成需求,以支持快速增殖,并构成免疫抑制肿瘤微环境(immune suppressive tumor microenvironment, TME)。除肿瘤细胞源性细胞因子外,低pH和缺氧环境也参与MDSCs介导的免疫抑制调控。此外,增强的游离脂肪酸(FFAs)摄取、脂肪酸氧化(FAO)和脂质存在都明显有利于MDSCs介导的免疫抑制。
尽管乳酸在TME中起主导作用,但短链脂肪酸(SCFAs),包括醋酸酯(C2)、丙酸酯(C3)和丁酸酯(C4)一直被认为是许多生理和病理过程中的关键信号分子。然而,以往的研究主要集中在肠道微生物群产生的SCFAs对宿主稳态的调节上。最近的研究表明,糖酵解的最终产物丙酮酸(pyruvate)产生醋酸盐存在一种全新的途径。肿瘤中过度活跃的代谢如Warburg效应导致葡萄糖摄取增加,代谢不完全,代谢中间体如乙酸释放到细胞外空间。然而,SCFAs在肿瘤微环境中的免疫调节作用却鲜有研究。
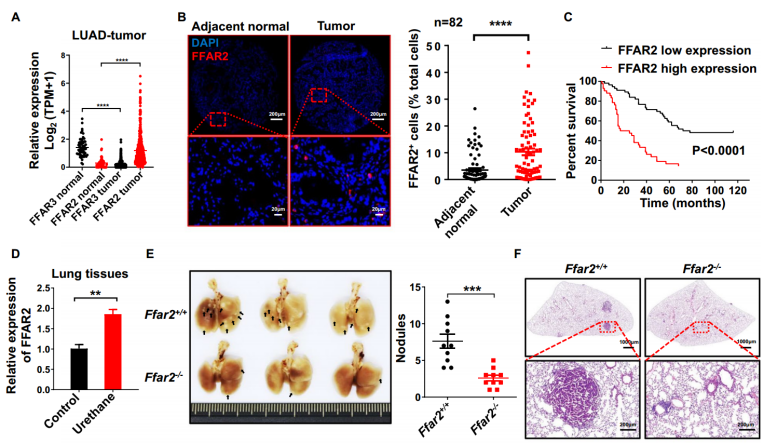
FFAR2缺失抑制肺癌的形成和发展(图源自Journal of Hematology & Oncology )
SCFAs在肿瘤微环境中的积累不仅增强了免疫细胞对SCFAs的摄取和碳代谢,而且通过G蛋白偶联受体(GPCRs)家族的游离脂肪酸受体(FFARs)增加了G蛋白的信号转导。作为经典的GPCR, FFAR2与Gαi/o和Gαq结合,抑制腺苷酸环化酶途径或增加细胞内钙水平。尽管FFAR2已被发现在多形核白细胞(PMNs)的迁移中发挥关键作用,并通过肠道微生物来源的SCFAs调节Treg池的大小和功能,但FFAR2在MDSCs介导的肿瘤免疫逃避中的功能尚不清楚。
该研究报告了SCFAs(乙酸)在患者和小鼠肿瘤组织中的显著积累,以及FFAR2在更具免疫抑制性的MDSCs中被乙酸激活,这被证明对免疫抑制和癌症进展至关重要。此外,还证明了FFAR2通过Gαq/Calcium/PPAR-γ/Arg1信号通路在MDSCs介导的L-精氨酸消耗中的非冗余作用。此外,药物抑制FFAR2信号显著促进了免疫检查点阻断(ICB)介导的肿瘤抑制,表明FFAR2作为癌症免疫治疗的新靶点的巨大潜力。因此,FFAR2可能作为消除病理活化的MDSCs和逆转免疫抑制肿瘤微环境的潜在新靶点,在改善癌症免疫治疗的临床效果方面具有很大的潜力。
原文链接:
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-024-01529-6