2024年1月22日,浙江大学刘云华、王达、钱俊斌及四川大学姜红共同通讯在Cancer Discovery(IF=28)在线发表题为”Receptor-interacting Protein Kinase 2 Is an Immunotherapy Target in Pancreatic Cancer “的研究论文,为了鉴定免疫抑制性TME的可药物调节因子,该研究使用原位PDAC模型进行了以激酶组(kinome)和膜组学(membranome)为重点的CRISPR筛选。该研究发现受体相互作用蛋白激酶2 (RIPK2)是细胞毒性T细胞杀伤的免疫逃避的关键驱动因素,并且RIPK2的遗传或药理学靶向使PDAC对抗程序性细胞死亡蛋白1 (anti-PD-1)免疫治疗敏感,从而延长生存期或完全消退。
机制研究表明,肿瘤固有的RIPK2消融通过消除NBR1介导的自噬-溶酶体降解,破坏促结缔组织TME,恢复MHC I类(MHC-I)表面水平。总之,该研究结果为一种由RIPK2抑制和抗PD-1免疫治疗组成的新型PDAC联合治疗提供了理论依据。
胰腺导管腺癌(PDAC)仍然是一种高度侵袭性和致死性的恶性肿瘤,平均5年总生存率低于10%。在过去的十年中,免疫疗法,特别是免疫检查点阻断(ICB),已被证明可以增强T细胞介导的免疫反应。ICB治疗目前正成为晚期皮肤、肺癌和结直肠癌患者最有前途的治疗选择。不幸的是,最近的临床试验报告称,由于遗传异质性和高度的结缔组织可塑性和免疫抑制肿瘤微环境(TME), PDAC对单药ICB和双药ICB治疗收效甚微。这强调了需要新的可操作的免疫靶点来改善PDAC的结果。
PDAC TME的特点是骨髓细胞的显著浸润,骨髓细胞通常缺乏细胞毒性T淋巴细胞(CTL)和低活化标志物。缺乏强大的预先存在的T细胞免疫是疾病进展和对ICB治疗不良反应的重要调节因素。然而,调节PDAC TME和T细胞免疫的分子机制尚未完全了解。有几个因素可以限制自然发生的T细胞免疫,如低细胞表面MHC I类表达、低突变负担和TME介导的T细胞启动和功能抑制。其中,MHC-I介导的抗原呈递下调是肿瘤逃避免疫系统监控的主要机制,如抗原加工途径(APP)基因的基因突变或表观遗传沉默。因此,在临床前模型中,自噬抑制恢复肿瘤细胞MHC-I表达或激动性抗CD40抗体促进T细胞启动可使难治性PDAC对ICB治疗敏感。这些发现促使研究人员发现新的肿瘤内在决定因素,以增加T细胞免疫治疗PDAC。
RIPK2调节免疫谱并损害抗肿瘤T细胞反应(图源自Cancer Discovery )
使用CRISPR/Cas9进行功能基因筛选已被证明是发现新的免疫靶点的强大而公正的工具。例如,一些基于流式细胞术的体外筛选已经揭示了程序性死亡配体1 (PD-L1)或MHC-I的多种肿瘤固有调节剂,这可能有助于免疫逃避CTL的杀伤。使用一组不同来源的癌细胞系的皮下肿瘤模型,汇集的体内筛选还发现了一组核心保守基因,包括Ptpn2、Setdb1、prm1、Cop1和Fitm2,这些基因的缺失可能会增强ICB免疫治疗。
考虑到不同基因肿瘤模型中TME的多样性,这些体外筛选或异位皮肤肿瘤模型并不能忠实地捕捉内源性TME中复杂的肿瘤-免疫相互作用。原位肿瘤模型将是筛选抗肿瘤免疫靶点的更相关的设置,但它们在技术上具有挑战性,可能不适合基因组的广泛筛选。因此,对于体内CRISPR筛选来说,使用小型的、集中的文库通常是一种更实用的策略。然而,使用原位PDAC模型的集中功能遗传筛选尚未用于系统地识别生物学相关的免疫靶点。
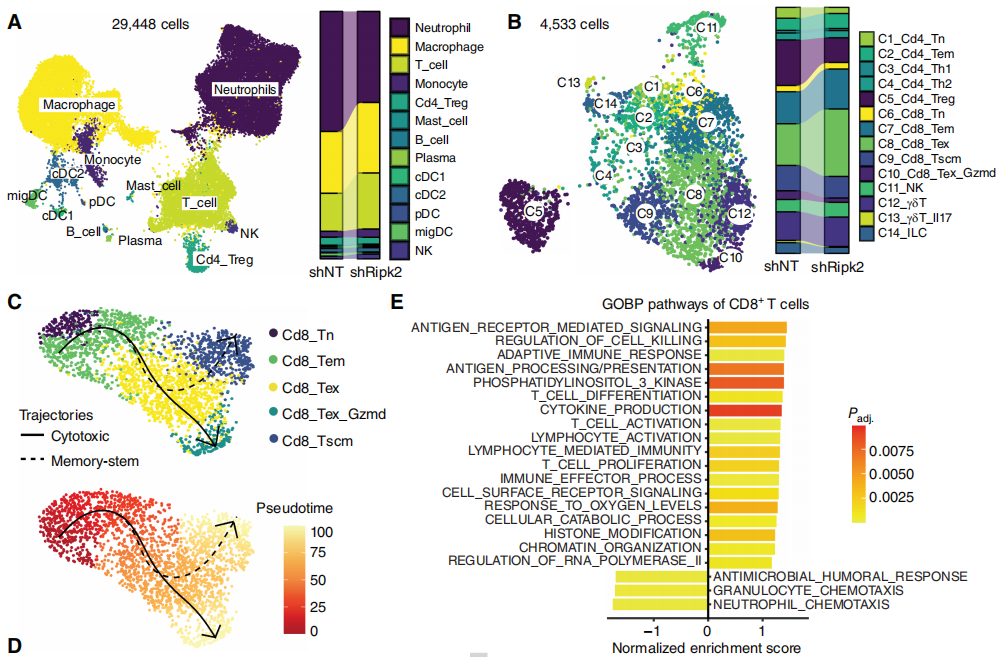
该研究进行了体内筛选,系统地鉴定了靶向激酶组(kinome)和膜组学(membranome)的可药物免疫靶点。通过原位PDAC模型,该研究发现与免疫缺陷小鼠相比,野生型小鼠中靶向受体相互作用蛋白激酶2 (RIPK2)的多个引导RNA显著减少。Ripk2编码核寡聚结构域(NOD)样受体(NOD1/2)的下游衔接蛋白,在先天免疫和炎症中起关键作用。基因消融或药物抑制RIPK2使PDAC对ICB治疗敏感,导致完全或部分消退和延长生存期。在机制上,RIPK2驱动结缔组织的TME,并限制肿瘤浸润效应T细胞的激活和密度,特别是通过诱导NBR1介导的MHC-I的自噬-溶酶体降解。因此,该研究确定了RIPK2可能是一个以前未被重视的免疫治疗靶点,为RIPK2抑制和ICB免疫治疗的新型联合治疗提供了理论依据。
参考消息:
https://aacrjournals.org/cancerdiscovery/article-abstract/doi/10.1158/2159-8290.CD-23-0584/733555/Receptor-interacting-Protein-Kinase-2-Is-an?redirectedFrom=fulltext