2024年4月17日,上海交通大学闫小响、张瑞岩、首都医科大学Gao Fei共同通讯(马文琦、贾康妮及程豪迈为论文的共同第一作者)在Circulation Research (IF=20)在线发表题为“Orphan Nuclear Receptor NR4A3 Promotes Vascular Calcification via Histone Lactylation”的研究论文,该研究表明孤儿核受体NR4A3通过组蛋白乳酸化促进血管钙化。NR4A3在慢性肾病小鼠、1,25(OH)2VitD3超载小鼠和人钙化主动脉组织中的表达上调。NR4A3缺乏保留了血管平滑肌细胞的收缩表型,抑制了成骨细胞分化相关基因的表达,减少了血管中的钙沉积。此外,NR4A3缺乏降低了钙化过程中的糖酵解速率和乳酸生成,并降低了组蛋白的乳酸化。
机制研究进一步表明,NR4A3通过直接结合2个糖酵解基因ALDOA和PFKL的启动子区域并驱动其转录起始,从而增强糖酵解活性。此外,组蛋白乳酸化在体内和体外都促进了中层钙化。NR4A3缺乏抑制了Phospho1(磷酸酶孤儿1)的转录激活和表达。一致地,在NR4A3过表达的血管平滑肌细胞中,Phospho1的药理抑制减弱了钙沉积,而过表达的Phospho1逆转了NR4A3缺乏在血管平滑肌细胞中的抗钙作用。综上所述,该研究表明NR4A3介导的组蛋白乳酸化是一种新的代谢组-表观基因组信号级联机制,参与了中层动脉钙化的发病机制。
动脉中层钙化(Medial arterial calcification, MAC)的特征是磷酸钙的积累与羟基磷灰石晶体的形成,并与血管中层内的进行性石化有关。MAC常见于衰老和几种代谢性疾病,如动脉粥样硬化性心血管疾病、慢性肾脏疾病(CKD)和糖尿病。MAC与动脉僵硬,舒张性心力衰竭,高血流量器官灌注受损的增加密切相关。目前,严重MAC的治疗方案,如CKD合并尿毒症的透析患者,主要包括控制矿物质干扰。此外,侵入性手术,如眼眶和旋转病灶切除术,可用于治疗严重钙化病变。然而,这些实验性治疗方法的疗效有限,并不能完全去除钙积聚。
MAC的发生是由复杂的细胞内机制介导的,包括钙和磷酸盐稳态的损害,表观遗传途径的激活,DNA氧化损伤的诱导,成骨细胞特异性TFs(转录因子)的激活,钙化基质囊泡的沉积。尽管在这一领域取得了进展,但对MAC的初始驱动程序仍然知之甚少。血管平滑肌细胞(VSMCs)是动脉中层的主要细胞。当VSMCs分化为成骨细胞时,特征性的平滑肌标记物丢失,形成成骨细胞样特征,这代表了血管钙化的关键事件。一些证据表明VSMCs的表型变化与葡萄糖代谢之间存在密切联系。在动脉粥样硬化斑块纤维帽内的VSMCs中观察到糖酵解活性增强。最近的发现表明,一些糖酵解相关基因在钙化的VSMCs中上调。然而,糖酵解代谢物在血管钙化中的作用及其可能的机制仍然知之甚少。
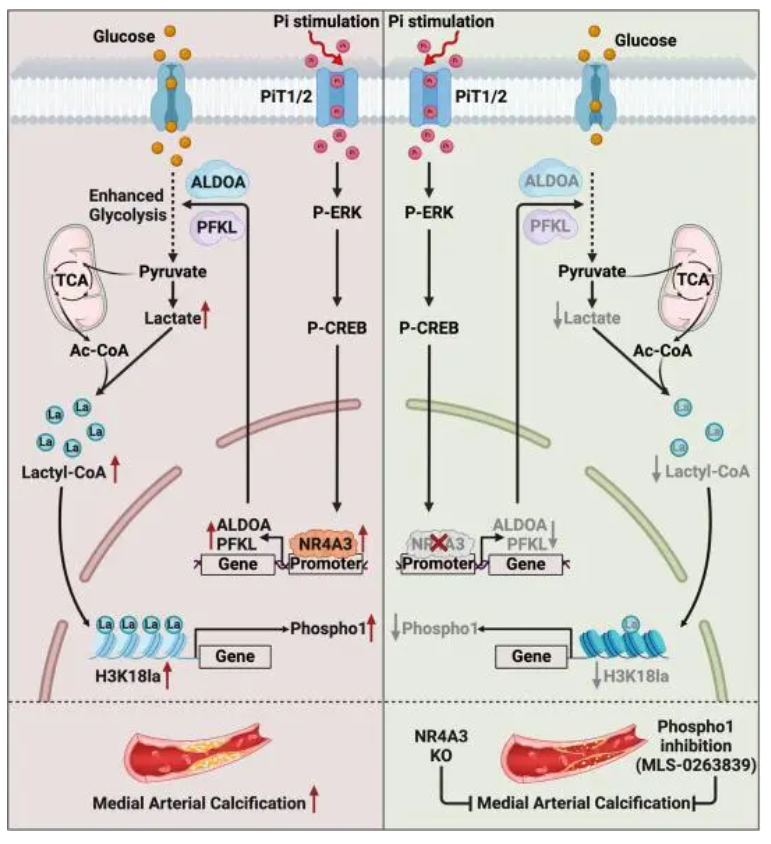
机理模式图(图源自Circulation Research )
核受体4A3 (NR4A3,也称为NOR-1)与NR4A1和NR4A2是属于NR4A孤儿核受体亚家族的TFs。所有3个NR4A成员在心血管疾病中调节参与细胞增殖、分化、凋亡、炎症和代谢的基因表达方面的作用被广泛研究。NR4A受体是立即早期基因,它们的激活通常是短暂的。因此,这些早期反应TFs在调节晚期反应基因转录起始中的作用尚未被广泛探索。在成骨细胞中,NR4A受体已被证明可调节成骨细胞基因的表达和分化。
据报道,NR4A受体在人冠状动脉粥样硬化病变中高表达,NR4A3缺乏可减少血管损伤后VSMCs的增殖和迁移以及新生内膜的形成。因此,NR4A3可能在介导VSMC表型转换中发挥重要作用。该研究通过整合多组学分析发现NR4A3介导的乳酸生成促进组蛋白H3 (H3K18la)赖氨酸18的乳酸化,这有助于激活Phospho1(磷酸酶孤儿1)的表达,从而加速动脉钙化。该研究结果表明,靶向NR4A3介导的代谢组-表观基因组信号级联可能为预防动脉钙化提供新的见解。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.123.323699