2024年4月11日,江南大学周哲敏和韩来闯共同通讯在Advanced Science 发表题为“A New-Generation Base Editor with An Expanded Editing Window for Microbial Cell Evolution In Vivo Based on CRISPR‒Cas12b Engineering”的研究论文,该研究通过对CRISPR/Cas12b进行设计,创制出“新一代碱基编辑器”,实现微生物细胞(Bacillus subtilis和Escherichia coli)的高效且大范围的碱基编辑。
值得注意的是,该“新一代碱基编辑器”在微生物细胞中的编辑窗口表现惊人,达到了42~64 nt,是当前微生物细胞中编辑窗口最宽的BE,最多实现8个以上氨基酸的替换,为微生物体内靶向突变以及合成生物学其他方面研究提供了重要的遗传工具。
对于微生物底盘进化而言,突变通常需要发生在一个较大的编辑窗口内,通过迭代基因组编辑实现目标基因的多样化从而产生大量的表型;结合有效的高通量筛选技术,加速底盘细胞的开发。然而,微生物细胞中现存的BE通常具有狭窄的编辑窗口(5~7 nt),对应至多发生2~3个氨基酸的替换,这限制了BE在基因多样化中的潜力。尽管通过sgRNA的延长以及多类型脱氨酶的融合可以在一定程度上扩展BE的编辑窗口(周哲敏课题组前期工作,Hao et al. Nucleic Acids Res. 2021, 49(16): 9594-9605; Hao et al. Chem. Sci. 2022, 13: 14395-14409),但是其在靶标处的可编辑范围依然有限。
针对上述关键科学问题,本研究选择Cas12b作为构建BE的候选Cas蛋白,由于其体积相较于Cas9、Cas12a更小,因此将其与脱氨酶进行连接可以避免Cas蛋白体积过大导致的空间位阻对于脱氨酶可作用活性范围的限制。首先在B. subtilis中涉及创制了基于CRISPR/Cas12b的基因编辑系统。
接下来,基于序列比对、分子动力学模拟以及分子对接策略,发现了影响Cas12b DNA核酸酶活性的关键位点并首次构建了失活版本的dBhCas12b,并将其用于B. subtilis的基因表达调控中(CRISPRi)。本研究将改造的dBhCas12b与胞苷脱氨酶(PmCDA)进行联用,分别设计构建了四个CBE体系。其中将CDA融合到dBhCas12b的N端并额外添加两个拷贝的UGI的构建策略(CDA-dBhCas12b-UGI-UGI)能够在B. subtilis中诱导C到T的突变且编辑窗口约为16 nt;此外将改造后的腺苷脱氨酶ABE8e融合到dBhCas12b的N端构建ABE体系,编辑实验显示该系统能够高效诱导A到G的突变,且编辑窗口达到14 nt。进一步地,本研究还将新一代碱基编辑器应用于B. subtilis中RBS+Spacer的大窗口(15 nt)多样化中,通过构建RS组合突变文库,以最大程度调控基因的表达。
为了测试新一代BE在其他微生物细胞中的普适性,本研究还在E. coli (JM109和BL21) 中构建了一个基于温敏质粒的CBE体系进行验证。群体和单克隆测序结果均发现,新一代CBE的编辑窗口高达41~63 nt,甚至超出了protospacer的长度(23 nt)。经全基因组测序(WGS)发现,dBhCas12b-CBE并没有发生可检测的脱靶效应,证明了该新一代BE系统是一个高精度的基因组编辑器,其编辑窗口是目前已报道BE的8~10倍,是迄今微生物系统中报道的编辑窗口最宽的BE。
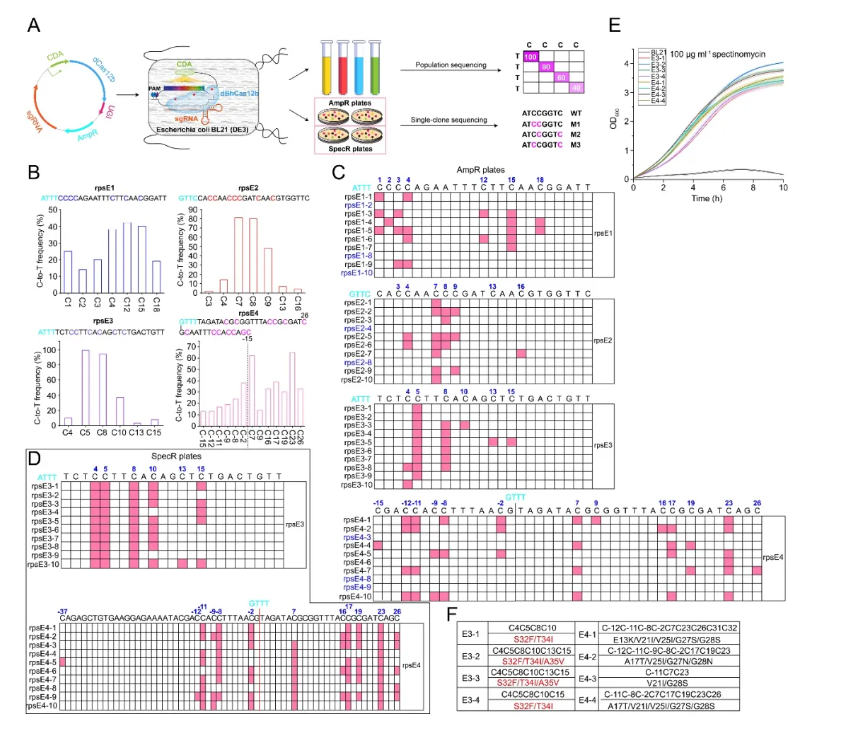
图 新一代BE在E. coli中设计与功能验证(图源自Advanced Science )
江南大学生物工程学院2019级博士毕业生郝文亮(现为清华大学化学工程系2023级博士后)为论文的第一作者,周哲敏教授和韩来闯助理研究员为论文的共同通讯作者。本课题组崔文璟副教授给予了本人大力支持,江南大学未来食品科学中心武耀康副教授也为本项研究的开展给予重要帮助。
参考消息:
https://pubmed.ncbi.nlm.nih.gov/38613787/