2024年3月27日,中国科学院分子植物科学卓越创新中心/中国科学院合成生物学重点实验室张余研究组(曾媛为论文的第一作者)在Nature 在线发表题为”Structural basis of exoribonuclease-mediated mRNA transcription termination“的研究论文,该研究报道了与5 '至3 '外核糖核酸酶Rat1及其伙伴Rai1结合的酿酒酵母 Pol II预终止转录复合物的两个冷冻电镜结构。
结构表明,Rat1取代了延伸因子Spt5,停靠在Pol II茎结构域。Rat1屏蔽Pol II的RNA出口通道,引导新生RNA走向其活性中心,并在新生RNA的5 '端堆叠三个核苷酸。这些结构进一步表明,Rat1在缩短RNA时向Pol II旋转。总之,该研究揭示了酵母mRNA转录终止的分子机制。
转录作为中心法则中必不可少的一步,在基因表达过程中承担重要作用。转录按照其反应过程可以分为转录起始,转录延伸,转录终止。近年来转录起始和转录延伸的机制逐渐被揭开。然而,由于转录终止的动态和不稳定特性,其机制仍不清楚。转录终止(transcription termination)是指RNA聚合酶(RNA polymerase,RNAP)停止RNA延伸、释放RNA并从DNA解离的过程。正确的转录终止对mRNA的稳定性和RNA聚合酶的高效循环利用至关重要。酵母细胞RNA聚合酶II(RNA polymerase II,Pol II)的转录终止机制根据其合成的RNA类型主要分为两类,第一类是mRNA的转录终止,第二类是non-coding RNA的转录终止。
mRNA的转录终止机制在真核生物中普遍保守。当Pol II转录至基因末端的多聚腺苷化信号(Polyadenylation Site; PAS)时,pre-mRNA在PAS位点下游被切割分为两段。切割后的mRNA完成PolyA加尾后被转运至细胞质翻译,而Pol II仍然朝下游转录继续合成RNA,其转录终止依赖一个保守的5’-3’ RNA外切酶(酵母Rat1,哺乳动物XRN2,植物XRN3),针对真核细胞mRNA转录终止的机制已经被研究了多年,提出了包括“鱼雷”、“异构”等多个模型,但是其机制尚存争议。异构模型认为,核酸外切酶Rat1结合诱导Pol II构象变化,促进mRNA自发解离。鱼雷模型认为,核酸外切酶Rat1切割下游RNA并追赶Pol II,当Rat1赶上Pol II后触发mRNA解离。转录终止具体通过何种机制尚存争论。
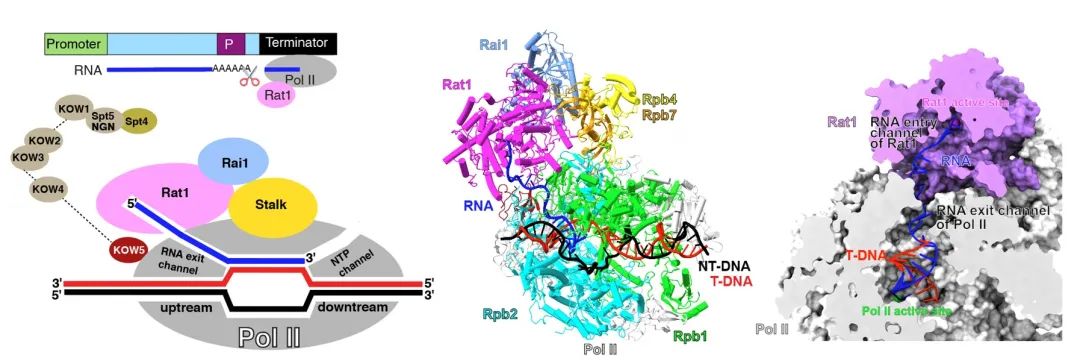
图1 外切酶Rat1与Pol II形成的复合物
鉴于mRNA转录终止过程快速连续,难以捕捉其中间状态。研究团队利用磷硫键修饰的不同长度RNA组装Pol II转录终止复合物,重构了外切酶缩短RNA的中间态过程,并解析了上述中间状态的复合物结构(图1)。研究团队发现外切酶稳定结合在Pol II的RNA通道外侧,RNA从Pol II的活性中心延伸到了外切酶的活性中心。外切酶的结合位置和Pol II的转录延伸因子互相重叠,外切酶结合促使了延伸因子的解离,解释了外切酶延缓Pol II转录延伸速率的原因。根据以上结构信息,研究团队提出了外切酶介导的mRNA转录终止机制:外切酶覆盖RNA通道出口,直接将Pol II转录的RNA引导至催化中心,利用其RNA外切酶和移位酶缩短RNA长度的同时,对mRNA产生牵引力从而将其从Pol II 催化中心拖拽出来,最终解离mRNA并终止Pol II 转录(图2)。研究团队的工作表明mRNA的转录终止符合修正版的“鱼雷”模型,Pol II类似航行的军舰、外切酶鱼雷追赶上Pol II之后,吸附在Pol II上,随后利用其水解RNA转化的机械力将RNA从Pol II中拖拽出来。
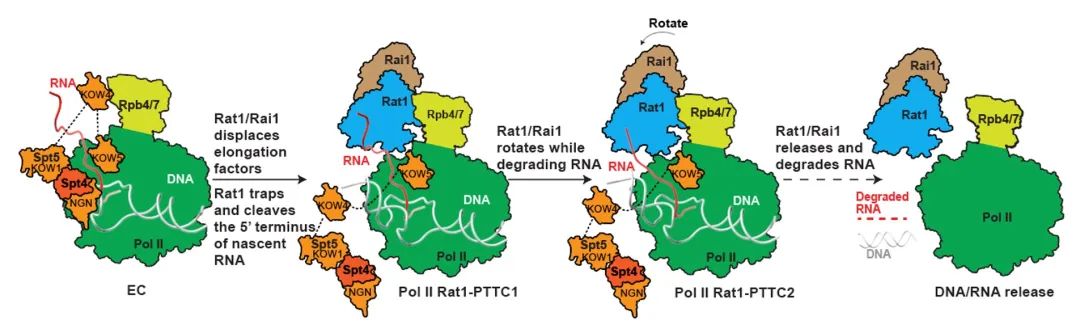
图2 外切酶Rat1介导的转录终止模型
比较细菌、古菌和真核生物mRNA转录终止,研究团队提出三域生物利用相似的方式终止mRNA合成。这些终止因子均结合在聚合酶的RNA通道外侧,真核生物利用Rat1/XRN2/XRN3的外切酶活性解离mRNA,细菌利用Rho的RNA移位酶活性解离mRNA,古菌利用FttA的外切酶活性解离mRNA。
中国科学院分子植物科学卓越创新中心张余组博士生曾媛(已毕业)为论文的第一作者,张余研究员为通讯作者。本课题受到上海市基础研究特区计划,科技部重点研发计划资助。
参考消息:
https://www.nature.com/articles/s41586-024-07240-3