3月16日,宁波大学研究学者在期刊《Cell Death & Disease》上在线发表题为“HMGA2 alleviates ferroptosis by promoting GPX4 expression in pancreatic cancer cells”的研究论文,本研究阐明了HMGA2通过抑制铁死亡来增强胰腺癌细胞死亡抵抗力的机制。这是通过激活mTOR信号通路和随之而来的GPX4水平增加实现的。这些发现为未来克服胰腺癌化疗耐药性的治疗方法提供了潜在的靶点。
研究背景
胰腺癌是恶性最强的肿瘤类型之一,也是两性癌症相关死亡的第四大原因。胰腺癌通常未被发现,进展迅速,直到晚期并扩散,因此难以及时诊断。胰腺癌的临床治疗可分为手术、化疗和放疗三部分。由于胰腺癌的高放射耐药性,以及邻近器官无法耐受高剂量的辐射,因此治愈胰腺癌的唯一方法是完全切除和全身化疗相结合。然而,最近的研究表明,胰腺癌具有异质性细胞组成和冷肿瘤微环境,导致对新辅助化疗和/或放疗的耐药性。
研究发现
在本研究中,研究人员证明了HMGA2在胰腺癌组织中高度表达,主要分布在上皮细胞中,并且代表了高上皮-间充质转化的亚型。HMGA2 的缺失通过细胞增殖、转移和体内异种移植肿瘤生长来抑制肿瘤恶性。此外,HMGA2通过抑制活性氧和促进谷胱甘肽的产生来增强细胞氧化还原状态。过表达HMGA2的细胞中铁死亡得到显著改善。相反,HMGA2缺失加剧了铁死亡。
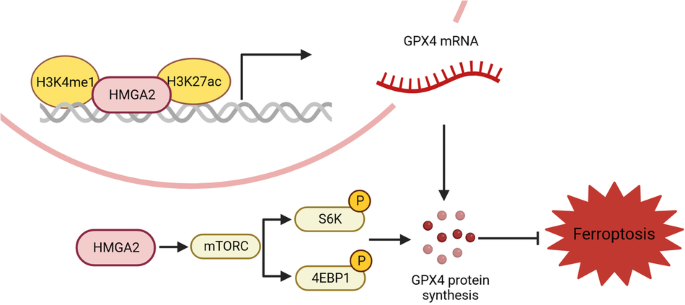
机制上,HMGA2通过转录和翻译调控激活GPX4表达。HMGA2通过增加H3K4甲基化和H3K27乙酰化来增强增强子活性,从而结合并促进GPX4基因启动子区域的顺式元件修饰。此外,HMGA2通过mTORC1-4EBP1和-S6K信号轴刺激GPX4蛋白合成。HMGA2的过表达缓解了mTORC1药理学抑制导致的GPX4蛋白水平下降。相反,与对照组相比,HMGA2缺失更强烈地降低了4EBP1和S6K的磷酸化。使用免疫组织化学染色证实了HMGA2和GPX4表达之间的强正相关。研究人员还证明,HMGA2减轻了癌细胞对铁死亡诱导剂和mTORC1抑制剂或吉西他滨联合治疗的敏感性。研究结果揭示了HMGA2协调GPX4表达的调控机制,并强调了靶向HMGA2在癌症治疗中的潜在价值。
研究结论
综上所述,本研究阐明了HMGA2通过抑制铁死亡来增强胰腺癌细胞死亡抵抗力的机制。这是通过激活mTOR信号通路和随之而来的GPX4水平增加实现的。这些发现为未来克服胰腺癌化疗耐药性的治疗方法提供了潜在的靶点。
参考资料:
https://www.nature.com/articles/s41419-024-06592-y