2024年3月13日,中国科学院动物研究所曲静课题组、刘光慧课题组联合中国科学院北京基因组研究所张维绮课题组在Developmental Cell 在线发表了题为“The sirtuin-associated human senescence program converges on the activation of placenta-specific gene PAPPA”的研究论文,该研究深度探究了七个sirtuin家族成员通过调节染色质三维结构调控人干细胞衰老的作用,揭示了其共性调控的基因组热点区域;作为七个sirtuin蛋白的共同靶基因,胎盘特异蛋白PAPPA可因任何一个sirtuin蛋白的缺失而发生异位表达,进而触发细胞衰老程序。研究为阐明人类干细胞衰老机制提供了全新见解,同时也为评估和干预衰老提供了新的线索和思路。
研究人员通过基因组靶向编辑技术,获得了SIRT1-7分别敲除的人类胚胎干细胞,并将其定向分化为间充质干细胞。SIRT1-7中任一成员在间充质干细胞中的缺失均导致细胞的加速衰老。为了探究sirtuin不同成员调控人类间充质干细胞衰老的具体机制,研究人员通过ChIP–seq对sirtuin家族蛋白的经典底物H3K9ac、H3K18ac和H3K56ac进行了全基因组范围的分析。发现在任一sirtuin缺失后,这三种组蛋白乙酰化修饰的程度均增加,提示不同的sirtuin家族成员均直接或间接的参与了细胞核内的表观遗传调控。进一步,研究人员对sirtuin缺失的人间充质干细胞展开了多层次表观修饰图谱绘制,包括激活型和抑制型在内的多种组蛋白修饰(H3K27ac、H3K4me3、H3K4me1、H3K36me3、H3K9me3和H3K27me3)、DNA甲基化、染色质开放度、以及核纤层与染色质互作等。结合基于机器学习模型的染色质状态分析,研究人员发现sirtuin成员缺失可导致特定染色质区域出现激活型增强子状态的扩增,这些区域被定义为“sirtuin缺失敏感的基因组区域(sirtuin deficiency-sensitive genomic regions, SDSRs)”。
考虑到增强子活性的增加可能会导致染色质局部接触的重新建立,研究人员借助染色质构象捕获测序技术(Hi-C)探究了sirtuin蛋白缺失对染色质高级结构的影响,并观察到任一sirtuin缺失都会引起染色体内短距离相互作用增加。这种互作增加主要出现在富含SDSR的染色质拓扑结构域(TAD)内部,导致了增强子-启动子染色质环(E-P loop)强度增加,二者空间距离拉进,进而诱导一系列基因表达。胎盘特异基因PAPPA是SIRT1-7分别缺失后共性上调表达的基因,其异位表达介导了sirtuin蛋白缺失所致的促衰老效应。进一步研究表明,PAPPA的表达上调是多种类型人类细胞衰老的“共性驱动力”。此外,老年人血浆中PAPPA的蛋白水平显著高于年轻人,提示其可作为度量人类衰老的潜在的生物标志物。
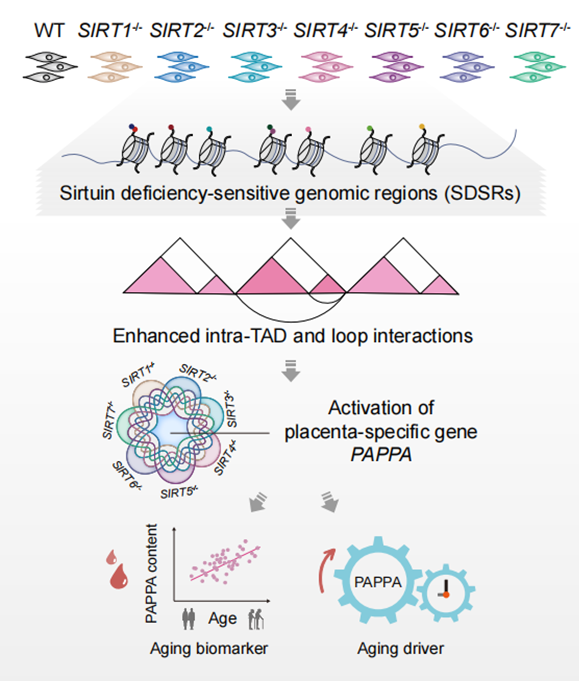
图:Sirtuin长寿蛋白家族通过维持染色质结构抑制人干细胞衰老
综上,该项研究系统地刻画了sirtuin家族成员调控人类干细胞衰老的多层次表观遗传景观图,揭示了sirtuin蛋白协同捍卫染色质高级结构稳定性、拮抗促衰老基因表达的全新分子机制。研究加深了人们对人类衰老表观遗传调控的认识,为发展新型的衰老评估与干预策略提供了重要的思路。
中国科学院动物研究所曲静研究员、刘光慧研究员,以及中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员为论文的共同通讯作者。中国科学院动物研究所博士研究生毕诗佳、蒋晓钰、季乾昭、王泽华,中国科学院北京基因组研究所(国家生物信息中心)任捷研究员,首都医科大学宣武医院王思研究员以及北京大学第三医院于洋教授为文章的并列第一作者。
文章链接:
https://doi.org/10.1016/j.devcel.2024.02.008