2024年1月29日,中山大学王红胜团队在National Science Review(IF=21)在线发表题为“N6-methyladenosine facilitates mitochondrial fusion of colorectal cancer cells via induction of GSH synthesis and stabilization of OPA1 mRNA”的研究论文,该研究发现N6-甲基腺苷通过诱导GSH合成和稳定OPA1 mRNA促进结直肠癌细胞的线粒体融合。该研究发现RNA m6A加速了结直肠癌细胞的线粒体融合。代谢组学分析和功能研究表明,m6A通过上调RRM2B触发谷胱甘肽的产生,RRM2B是一种p53诱导的具有抗ROS潜力的核糖核苷酸还原酶亚基。这反过来导致CRC细胞的线粒体融合。
机制上,m6A在RRM2B的3'UTR处甲基化A1240,通过与IGF2BP2结合增加其mRNA的稳定性。同样,在线粒体内膜融合必需的GTPase蛋白OPA1的CDS处,A2212的m6A甲基化也增加了mRNA的稳定性并触发了线粒体融合。通过甲基转移酶抑制剂STM2457或dm6ACRISPR系统靶向m6A可显著抑制线粒体融合。体内和临床数据证实了m6A/线粒体动力学在肿瘤生长和CRC进展中的积极作用。总的来说,m6A通过诱导GSH合成和OPA1表达促进线粒体融合,促进癌细胞生长和结直肠癌的发展。
线粒体动态包括线粒体裂变和融合,是线粒体形态在不同生理条件下的变化。融合/裂变过程是由线粒体外膜上的丝裂蛋白1 (MFN1)和MFN2以及线粒体内膜上的视萎缩蛋白1 (OPA1)之间的同型和异型相互作用调节的。线粒体融合的功能对于维持健康的线粒体群体至关重要。例如,OPA1对于线粒体内膜(IMM)融合和电子传递链(ETC)超级复合物的排列至关重要。而OPA1的缺失会导致线粒体网络的崩溃,损害线粒体形态,并促进细胞凋亡。此外,线粒体动力学和生物能量学相互影响。氧化磷酸化(OXPHOS)活性的增加可以刺激线粒体融合导致延伸。
研究表明,线粒体动力学功能障碍通过干扰细胞凋亡、能量产生和信号转导,对癌症进展至关重要。结直肠癌(CRC)是世界上第三大流行的癌症和第二大致命的恶性肿瘤,线粒体动力学有助于肠道炎症、结直肠肿瘤发生和结直肠癌转化的发病机制。例如,脂肪酸诱导的线粒体裂变增强了结肠癌中的Wnt信号,从而调节体内肿瘤类器官的形成和异种移植肿瘤的生长。缺氧诱导的OMA1-OPA1轴激活增加了CRC细胞的线粒体活性氧(ROS)并促进了糖酵解。鉴于线粒体动力学在维持细胞结构和功能中起着重要作用,研究其调控因子将对癌症治疗靶点的确定有很大帮助。
m6A是自20世纪70年代以来被发现的真核生物中最丰富的mRNA修饰。m6A在特定转录物中的动态修饰是由甲基转移酶样3 (METTL3)、METTL14、Wilms肿瘤1相关蛋白(WTAP)、m6A去甲基化酶脂肪质量和肥胖相关蛋白(FTO)和AlkB同源物5 (ALKBH5)组成的m6A甲基转移酶复合物控制的。m6A的mRNA修饰被m6A读取器识别,包括YTH结构域家族蛋白(YTHDF1/2/3)和胰岛素样生长因子2 (IGF2) mRNA结合蛋白家族(IGF2BP1/2/3 /3),以调节mRNA翻译、细胞定位、降解和调节蛋白质产生。作为基因表达的基本调控因子,m6A在细胞分化、胚胎发育和癌症发生等多种生物学过程中发挥作用。
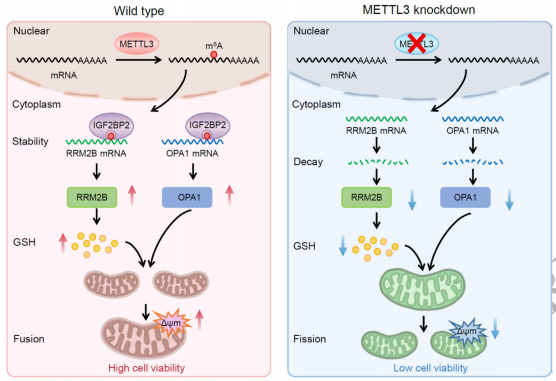
m6A通过诱导GSH和稳定OPA1促进CRC细胞线粒体融合的工作模型(图源自National Science Review )
最近的研究已经确定了线粒体动力学和一些表观遗传调节因子之间的联系。据报道,Sirt3介导的K931位点的OPA1去乙酰化,以及K834位点的一个新位点,在介导线粒体伸长中是重要的。而DNMT1通过作为线粒体动力学的表观遗传保护来维持脂肪细胞的代谢适应性。很少有证据表明m6A可能对线粒体裂变/融合和代谢至关重要。例如,FTO通过线粒体动力学的代谢调节促进胃癌的生长和转移。然而,m6A修饰是否能直接调节线粒体的裂变/融合,影响癌细胞的代谢,目前尚不清楚。
总的来说,该研究揭示了线粒体动态和m6A甲基化之间的新关系。具体来说,m6A通过激活RRM2B/GSH轴和上调OPA1来加速CRC细胞的线粒体融合。考虑到参与线粒体动力学的基因众多,m6A修饰通过影响其他基因间接调节CRC线粒体动力学似乎是合理的。该研究表明,m6A调节CRC细胞的线粒体动力学,这扩大了人们对这种相互作用的理解,这对治疗应用至关重要。
原文链接:
https://doi.org/10.1093/nsr/nwae039