2024年2月2日,清华大学生命学院刘俊杰(Jun-Jie Gogo Liu)团队在Science 在线发表题为“Hydrolytic endonucleolytic ribozyme (HYER) is programmable for sequence-specific DNA cleavage”的研究论文,在细菌II-C组内含子中,该研究发现许多没有内含子编码蛋白的系统在其驻留基因组中繁殖多个拷贝。这些内含子,被称为水解核内溶核糖酶(HYERs),裂解RNA,单链DNA,气泡双链DNA (dsDNA)和体外质粒。
HYER1在哺乳动物基因组中产生dsDNA断裂。冷冻电子显微镜分析揭示了HYER1的同二聚体结构,其中每个单体包含一个Mg2+依赖的水解口袋,并捕获与目标识别位点(TRS)互补的DNA。包括TRS扩展、招募序列插入和异源二聚化在内的合理设计产生了具有更高特异性和DNA操作灵活性的工程HYERs。
许多天然的催化RNA,被称为核酶,催化多种生化反应,如RNA剪接和聚合。II组(GII)逆转录转座子——特别是它们编码的内含子RNA——是一种有充分证据的核酶,能够在基因组的“复制和粘贴”逆转录转座子过程中催化酯交换反应。根据内含子RNA的序列和结构特征,GII逆转录转座子分为A、B和C三类。GII-C内含子的大小仅为GII-A和GII-B内含子的一半,被认为是更古老的。GII内含子通常由六个结构域组成。最大的结构域I (DI)通过与外显子结合位点(EBS)的碱基配对促进RNA外显子识别。结构域II和III (DII和DIII)是结构基序,维持稳定的核酶结构。结构域IV (DIV)通常包含一个编码内含子编码蛋白(IEP)的开放阅读框(ORF),其中包含DNA内切酶(EN)和逆转录酶(RT)结构域。形成RNA剪接核心的关键核苷酸位于结构域V (DV),剪接过程中负责酯交换反应的外溢腺苷(A)位于结构域VI (DVI)。
在逆转录过程中,内含子RNA最初以前体RNA形式(pre-RNA)与外显子一起转录。在IEP的辅助下,内含子RNA通过两个连续的酯交换反应进行自剪接,产生连接的外显子和分支内含子RNA。然后,分支内含子通过两步反向剪接插入到繁殖靶点内的DNA义链中。随后,在target-primed逆转录(TPRT)过程中,DNA反义链被EN结构域切割,启动IEP的RT结构域合成内含子cDNA。在TPRT后,内含子RNA模板被移除,宿主的DNA修复系统将其DNA拷贝粘贴到繁殖位点。由于序列特异性转座活性,由IEP和内含子RNA组成的GII逆转录转座子被重新用作细菌基因操作工具Targetron,它可以将内含子序列整合到目标位点以破坏基因功能。
已经发现了缺乏ORF的天然GII逆转录转座子。这些缺乏ORF的GII内含子通常被认为是GII逆转录转座子的“退化和无功能后代”,并且仍然缺乏特征。迄今为止,广泛使用的GII内含子数据库仅列出了42个经生物信息学分析鉴定的ORF较少的GII- A和GII-B系统。ORF较少的GII-C内含子尚未报道。对公开可用的细菌基因组序列的初步筛选发现许多GII-C逆转录转座子缺乏IEP编码的ORF。这些内含子中的一些存在于基因组的多个拷贝中,这表明不含IEP的逆转录转座子可能是活跃的,并且可能通过“复制粘贴”机制进行繁殖。
先前的体外实验表明,在不提供IEP的情况下,含有GII内含子的ORF可以通过水解而不是酯交换作用来识别和切割pre-RNA中的外显子,产生成熟的线性化内含子核酶。线性化的内含子核酶可以利用水分子攻击RNA-RNA或DNA-RNA键,在EBS互补RNA或DNA修饰的RNA底物上表现出水解内切酶活性)。然而,报道的内含子核酶在纯DNA上很少观察到实质性的水解裂解活性。
这些线索表明,未被表征的“繁殖”的ORF较少的GII-C内含子,自然不具有IEP,可能除了具有成熟的RNA切割能力外,还具有通过水解来切割繁殖位点DNA的能力。研究人员将这些假设的内含子核酶称为水解内核溶解核酶(HYERs)。与已报道的内含子核酶通过酯交换作用对DNA显示出核内溶活性相反。研究人员开始测试假设并发现HYERs。
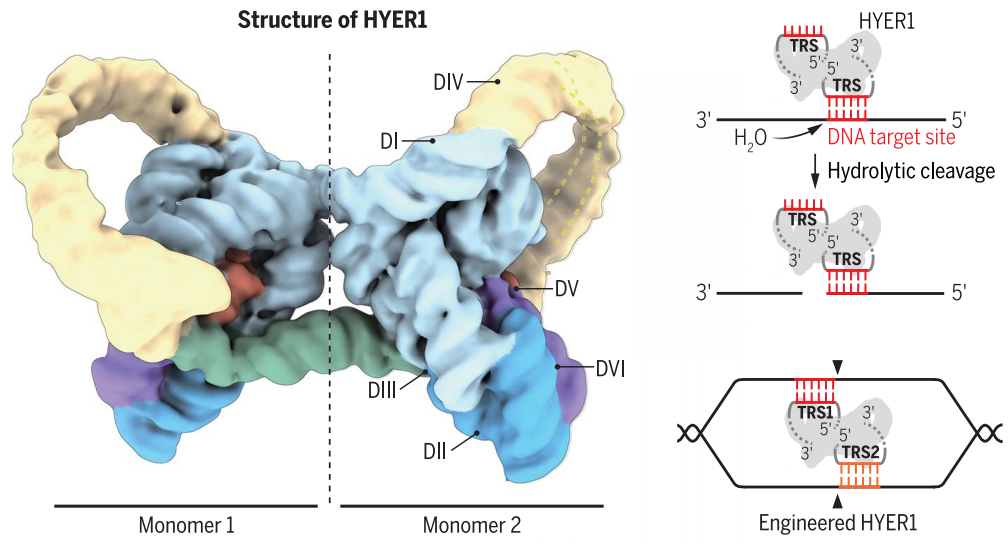
HYER1的水解DNA裂解(图源自Science )
在细菌II-C组内含子中,该研究发现许多没有内含子编码蛋白的系统在其驻留基因组中繁殖多个拷贝。这些内含子,被称为水解核内溶核糖酶(HYERs),裂解RNA,单链DNA,气泡双链DNA (dsDNA)和体外质粒。HYER1在哺乳动物基因组中产生dsDNA断裂。冷冻电子显微镜分析揭示了HYER1的同二聚体结构,其中每个单体包含一个Mg2+依赖的水解口袋,并捕获与目标识别位点(TRS)互补的DNA。包括TRS扩展、招募序列插入和异源二聚化在内的合理设计产生了具有更高特异性和DNA操作灵活性的工程HYERs。
清华大学生命学院刘俊杰副教授为该文通讯作者;清华大学生命学院博士生刘子贤、博士后张寿悦、博士生朱汉舟、博士后陈之航、博士生杨韵和博士生李隆骐为该文共同第一作者。此外,该项研究工作得到了中国科学院遗传与发育生物学研究所高彩霞课题组的大力支持。该工作由基金委原创项目(32150018)、农业部和清华大学提供经费和资源支持。
参考消息:
https://www.science.org/doi/10.1126/science.adh4859