ctDNA作为一种非侵入性的检测手段,为肿瘤治疗带来了新的突破。我们相信,最终随着具体适应症、ctDNA平台、治疗决策点和治疗意义的完善和验证,ctDNA很可能会被纳入到多方面的临床实践中。
肿瘤治疗领域一直在不断探索新的技术和方法,以提高治疗效果和患者生存率。近年来,液体活检技术中的ctDNA(循环肿瘤DNA)作为一种非侵入性的检测手段,在癌症早筛、MRD检测、复发监测、治疗选择和疗效监测等方面带来了新的突破,开启了精准医疗的新时代。
越来越多的研究表明,ctDNA是一种敏感且特异的复发生物标志物,可帮助临床医生优化治疗方案和监测策略。然而,这些研究大多是观察性的或个案的,且同行评议的关于ctDNA使用数据也主要是针对特定的适应症,缺乏一个在临床决策中的使用标准和实用建议。
《Nature》(IF:64.8)发表了一篇题为“在临床决策中使用ctDNA的实用性建议”的观点文章,就ctDNA的临床实用性及如何在不同的治疗环境中(特别是实体瘤)选择使用ctDNA检测分析提供概括性建议(包括临床意义及优缺点),以期达到最好的临床实践效果。
《Nature》观点文章--在临床实践中使用ctDNA的一般建议:

在临床实践中使用ctDNA的一般建议
文章首先讨论了术前基线及术后ctDNA检测的结果解释;然后讨论了基于ctDNA评估MRD时的技术考虑;再然后提出针对完成标准治疗后ctDNA-MRD阳性和ctDNA-MRD阴性患者的处理建议。最后,讨论了ctDNA检测在治疗反应监测中的应用,包括新辅助和辅助治疗等(特别是在免疫治疗的场景下)。
术前基线ctDNA检测
(1)术前基线ctDNA检测与肿瘤生物学特性相关:一些较小原发性肿瘤和某些特殊组织学肿瘤(如肉瘤、肾癌、肺腺癌、HR+乳腺癌和脑癌)的ctDNA脱落率较低,致使在诊断和/或进展时无法检测到ctDNA。

▲ 围术期肿瘤大小和亚型可以影响肿瘤脱落,从而影响术前基线ctDNA检测状态。1)上半部分图示显示:术前基线因肿瘤较小或某种亚型导致ctDNA未被检测到,术后患者仍然保持ctDNA阴性,但随着时间的推移,连续采样,肿瘤进展,可检被ctDNA-MRD检测到;2)下半部分图示显示:术前基线可检测到ctDNA,术后ctDNA立马转阴,但这并不排除MRD的可能性,因为ctDNA水平可能低于检测下限。随着时间的推移,纵向连续监测可以在影像学复发之前提前发现ctDNA-MRD
(2)tumor-informed ctDNA-MRD(Signatera)检测数据显示了早期肺癌、乳腺癌、肾癌和膀胱癌患者术前基线ctDNA状态与预后的关系:术前基线ctDNA检测为阴性患者与术前基线ctDNA检测为阳性患者相比具有更好的预后。

▲ 早期癌症患者术前基线ctDNA状态与无复发生存率(b)和总生存率(c)之间的关系:这些数据为Signatera的数据(平均测序深度>105,000X)
综合而言,术前基线ctDNA检测状态与长期预后之间的相关性尚不完全清楚。一些研究表明,术前基线ctDNA状态与预后之间没有相关性,但也有一些研究表明,术前基线ctDNA阳性与生存结果之间存在强相关性。因此,目前尚不清楚术前基线ctDNA检测状态是否以及如何影响临床决策。
手术后ctDNA检测
当确定手术后检测到ctDNA-MRD阳性时,患者的复发风险接近100%,但复发风险因癌症类型、ctDNA检测方法和是否进行纵向检测而异。
手术后检测到ctDNA-MRD的阳性率取决于肿瘤生物学特性和残留病灶的侵袭性。例如,与持续ctDNA-MRD阳性的患者相比,辅助治疗后ctDNA-MRD阴性患者的长期预后更好,而持续ctDNA-MRD阳性表明对治疗抵抗/耐药,可能是由于肿瘤异质性和克隆进化,导致最终复发。
ctDNA检测技术问题
MRD是一种与高复发风险相关的亚临床疾病,无法通过标准影像学方法检测到。使用ctDNA-MRD检测可以发现微小残留病灶,但需注意的是,ctDNA-MRD阴性结果仅表明复发风险降低,而不是保证不复发。
(1)术后ctDNA水平(MRD时间点)可能低于检测下限,呈现ctDNA-MRD阴性结果(假阴性),但随着ctDNA水平增加,检测到ctDNA-MRD阳性的概率也会提高。
(2)ctDNA水平在1.0拷贝/ml以上时,适合进行治疗反应监测,结果更可信;ctDNA水平如果低于0.1拷贝/ml时,检测结果较依赖概率抽样,难以作为判断依据,同时,也提示相邻采样时间点不宜过近(重复采样间隔时间不宜过短),否则很容易出现假阴性的结果。
(3)手术时间相对应的抽血时间也影响检测结果,cfDNA水平会随着手术创伤或癌症相关因素影响而增加,进而导致ctDNA背景增加出现更多假阴性检测结果(这可以通过纵向监测来克服)。因此,建议术后等待两周,再抽血进行ctDNA-MRD检测。还建议进行一个月的短期随访抽检,以确认ctDNA-MRD阴性结果。如果期间需要进行辅助治疗的话,这一检测间隔时间允许进行治疗。
(4)建议对ctDNA-MRD进行连续纵向监测,以避免任何假阴性或假阳性结果,从而提高检测方法在检测疾病复发方面的总体灵敏度和特异性(灵敏度:79%~100%,特异性:88%-100%)。
▲ ctDNA在不同临床情况下的检测:a)ctDNA-MRD检测时间线和治疗疗效监测的可能性;b)连续纵向监测可以提高ctDNA-MRD检测灵敏度
ctDNA阳性患者管理
越来越多的研究表明,ctDNA-MRD阳性可作为癌症复发的早期指标,并且与不良预后相关,但这可通过有效的全身系统性辅助治疗来改善。其次,治疗中的ctDNA清除率可作为治疗反应的一个指标,并且与良好预后相关,但仅是ctDNA清除率不足以预测长期生存获益(无病生存或无复发生存),因此仍建议根据既定的临床实践完成完成的治疗计划,无论治疗期间的ctDNA结果如何,以尽量减少未来复发的机会。
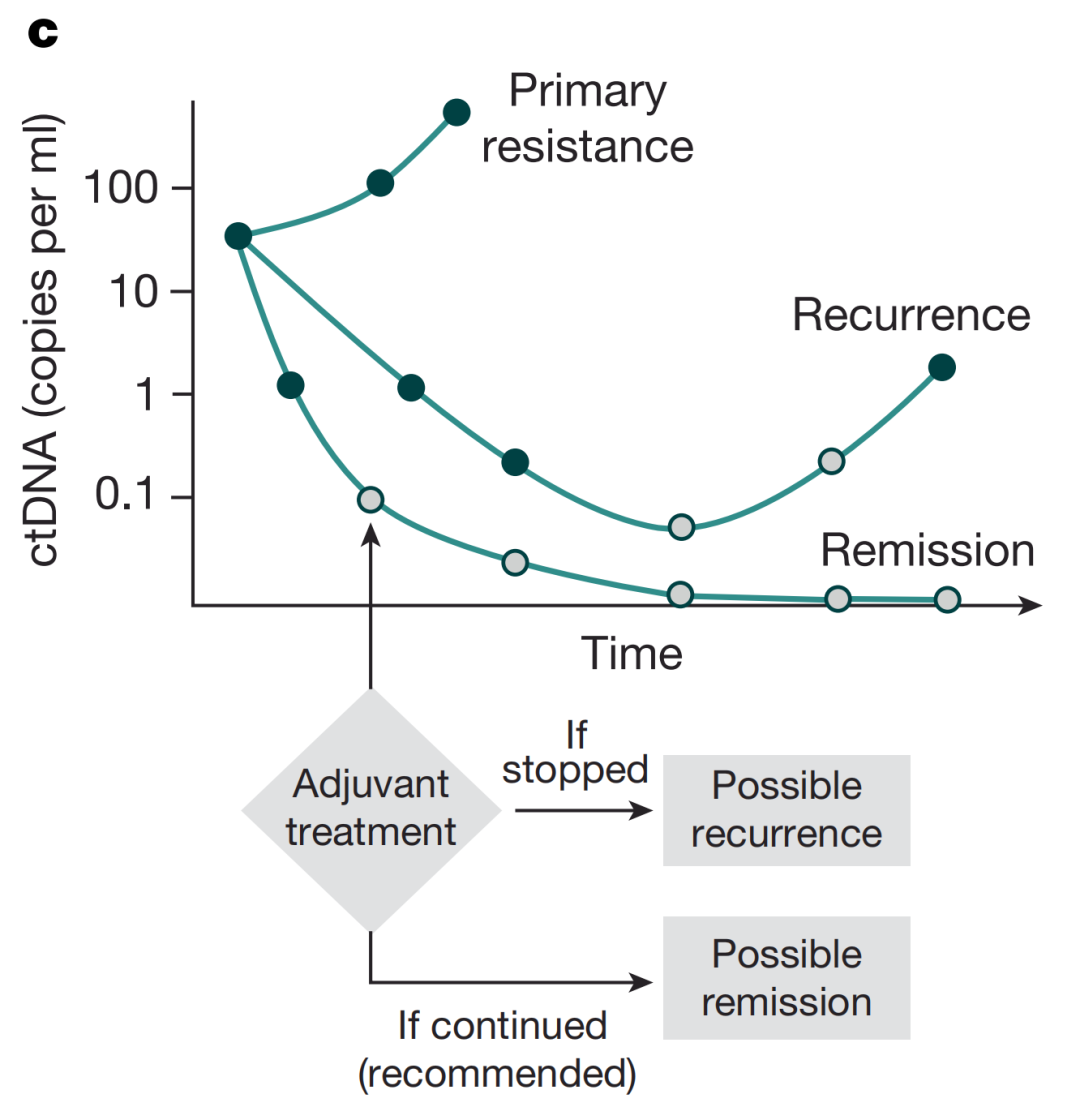
▲ 治疗后ctDNA的动态变化:ctDNA-MRD检测呈阳性的患者建议进行辅助化疗,ctDNA持续升高提示对治疗的原发性耐药;ctDNA水平下降,随后清除,表明成功的治疗反应,此时,建议患者完成治疗疗程以达到缓解,因为停止治疗可能会导致疾病复发
此外,现有的研究数据支持在结直肠癌、乳腺癌、肺癌和膀胱癌中等使用ctDNA-MRD进行患者管理。
ctDNA阴性患者管理
在辅助治疗期间,ctDNA持续阴性或转为阴性的患者预后显著改善。然而,ctDNA-MRD阴性并不能排除复发的可能性,这也取决于癌症类型。连续纵向检测为ctDNA-MRD阴性结果的复发风险低于单时间点检测结果,预后更好。
同时,ctDNA-MRD在检测ctDNA脱落率较低和血流较少的部位,如中枢神经系统、腹腔和肺等,可能具有挑战性,这时候检测血液以外的体液ctDNA(如尿液、唾液或脑脊液等)来监测疾病进展已展现出较好的前景。
最近的研究表明,ctDNA-MRD阴性患者辅助治疗的绝对获益较少,因为复发风险低。然而,与单独手术治疗的ctDNA-MRD阴性患者相比,辅助治疗的相对风险是否也降低或没有,目前正在研究中。
ctDNA治疗反应监测
ctDNA是监测新辅助/辅助治疗反应的强大工具,特别是在免疫治疗的场景下。
(1)新辅助治疗:如果新辅助治疗有效,可以考虑非手术治疗;新辅助治疗中ctDNA监测有助于预测手术前完全临床反应并预测生存结果,因此可指导后续的治疗,若ctDNA阴性可能提示观察等待,若ctDNA阳性可能提示需要手术。(由于ctDNA在确定局部疾病状态上的局限性,需要更多前瞻性研究和临床试验来佐证这方面应用)
(2)免疫疗法:ctDNA检测有助于解释免疫检查点抑制剂的临床反应。基线和治疗开始后不久检测ctDNA水平的变化可以预测免疫检查点抑制剂治疗晚期癌症患者的治疗反应。与ctDNA增加或保持稳定的患者相比,ctDNA清除率与长期生存相关。
(3)假性进展:大约10%接受免疫检查点抑制剂治疗的患者会出现假性进展。ctDNA可以在分子水平上准确、实时地识别假性进展(无需4-8周随访期),比如,未经证实的影像学进展可能伴随着ctDNA水平的降低,导致最终ctDNA清除(不过相关临床效用数据只有较小的回顾性队列数据);在真性进展的情况下,ctDNA状态可以为更快地转向替代疗法提供依据。
(4)超进展:大约4-29%接受免疫检查点抑制剂治疗的患者会出现超进展。超进展的关键标准包括治疗失败的时间少于两个月,与基线前影像学相比,疾病进展增加两倍或更多,并且患者的肿瘤负荷至少增加一倍。预计ctDNA的大幅、快速增加可能是超进展。然而,ctDNA动态与免疫治疗超进展的相关数据较少,是未来需要研究的课题。
(5)特殊响应者:对特定治疗方案有异常良好反应的患者被定义为特殊响应者。已知ctDNA快速清除与异常良好反应(特殊响应者)相关。识别特殊响应者可能有助于确定治疗持续时间,以便尽早停止治疗,并使患者免受与治疗相关的毒性和费用影响。(需前瞻性研究和临床试验进一步评估)
(6)免疫相关不良事件:当免疫相关不良事件发生时,ctDNA监测可能有助于确定是否应该继续免疫治疗,或停止免疫治疗使患者免于免疫相关不良反应,并降低医保成本。因此,建议在停止免疫治疗后继续进行ctDNA监测和标准的监测,以确定是否以及何时应采用替代疗法。重要的是,ctDNA在这一领域的作用仍有待详细研究。一项研究发现,ctDNA中检测到CEBPA、FGFR4、MET和KMT2B的特定变异与免疫相关不良事件的发生更密切。
综合而言,ctDNA作为一种非侵入性的检测手段,为肿瘤治疗带来了新的突破。我们相信,最终随着具体适应症、ctDNA平台、治疗决策点和治疗意义的完善和验证,ctDNA很可能会被纳入到多方面的临床实践中。具有明确临床终点的前瞻性研究将确定ctDNA是否可以补充甚至取代目前的标准临床指标。
参考资料:
1.Krebs, M. G. et al. Practical considerations for the use of circulating tumor DNA in the treatment of patients with cancer: a narrative review. JAMA Oncol. 8, 1830–1839 (2022).
2.Cohen, S.A., Liu, M.C. & Aleshin, A. Practical recommendations for using ctDNA in clinical decision making. Nature 619, 259–268 (2023).
3.Journal of Clinical Oncology 41, no. 4_suppl (February 01, 2023) 5-5.
4.Ohara, S. et al. Prognostic implications of preoperative versus postoperative circulating tumor DNA in surgically resected lung cancer patients: a pilot study. Transl. Lung Cancer Res. 9, 1915–1923 (2020).
5.Baumgartner, J. M. et al. Preoperative circulating tumor DNA in patients with peritoneal carcinomatosis is an independent predictor of progression-free survival. Ann. Surg. Oncol. 25, 2400–2408 (2018).