2024年1月18日,澳门大学王春明、南京大学董磊及郑鹏共同通讯在Journal of Hepatology(IF=26)在线发表题为“Molecular force-induced liberation of transforming growth factor-beta remodels the spleen for ectopic liver regeneration”的研究论文,该研究发现分子力诱导的转化生长因子-β的释放重塑了异位肝再生的脾脏。
sHA-X有效结合脾脏中丰富的潜伏TGF-β。它提供了分子力,将活性TGF-β二聚体从其潜在复合物中释放出来,模拟了TGF-β生理激活所需的“捆绑-拉动”机制,并重塑脾组织以支持肝细胞生长。引人注目的是,移植到重塑脾脏的肝细胞发育成具有足够体积的肝组织,在拯救90%肝切除术和代谢性肝脏疾病的动物(在Fah-/-转基因模型中)中发挥了强有力的功能,没有观察到不良反应,也不需要额外的药物。
转化生长因子-β(TGF-β)在组织发育和修复中起关键作用。刺激成纤维细胞分泌胶原构建细胞外基质(extracellular matrix, ECM)调节免疫细胞诱导免疫抑制,引导细胞增殖、迁移和分化。与大多数其他生长因子(GFs)不同,TGF-β对其胞外活性具有特殊的表达后调控作用。它以非活性潜伏形式从细胞分泌,其中活性TGF-β同二聚体包裹在与ECM共价连接的大潜伏复合物(LLC)中。只有在感应到适当的机械或生化信号时,LLC才会释放活性TGF-β。
这种复杂的激活机制为细胞外调节TGF-β活性提供了独特的可能性。例如,直接破坏LLC,以活性形式释放TGF-β,可立即增加后者在ECM中的含量。由于某些组织储存了大量的非活性TGF-β,而只有一小部分被激活,从LLC中释放这些储存的TGF-β可能会将其潜能释放到超生理水平,引发异常高的细胞反应。然而,TGF-β从LLC的精确解放仍未实现。自然,潜伏的TGF-β可以通过多种途径被激活,其中特别重要的是机械激活的方式。
在LLC中,活性TGF-β被一种与潜伏TGF-β结合蛋白-1 (LTBP1)相关的潜伏期相关肽(LAP)包裹。一方面,LLC与ECM成分结合,如原纤维蛋白,由其LTBP1和ECM中的糖胺聚糖(GAG)多糖之间的相互作用介导;另一方面,LLC可以结合细胞表面整合素受体(通过LAP的Arg-GlyAsp或RGD序列)。这些结合共同产生的收缩力解离复合物,释放活性TGF-β。这种原位机械激活是TGF-β特异性的,比典型的生化激活模式(如蛋白酶或活性氧)更可控。
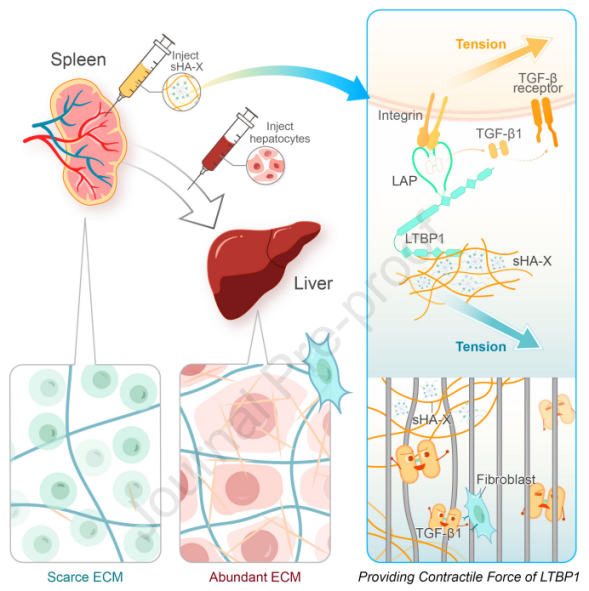
机理模式图(图源自Journal of Hepatology )
机械激活TGF-β的系统应该通过提供i)对LTBP1的生化亲和力和ii)机械支持来模拟ECM,以配合细胞表面整合素对LLC施加收缩力。由于GAG多糖是与LTBP1相关的一线ECM分子之一,可以介导LLC-ECM相互作用,并且由于多糖具有良好的物理性质和化学可加工性,开发一种具有ECM上述两个关键特征的聚糖生物材料。然后,选择脾脏来测试该系统,脾脏天然具有低ECM含量和高潜伏TGF-β储存。
该研究展示了一种瞬间增加局部TGF-β活性的工程方法,该方法完全重塑了天然脾脏的流体状态,使其成为纤维化基质,以支持移植肝细胞的生长。与所有现有方法不同,该策略针对TGF-β活化的独特机制。设计的LTBP1结合交联基质提供了将多能GF从其潜在复合物中解放出来所需的机械力,而无需引入外源基因或蛋白质,整个过程在局部和细胞外完成。由于无活性复合物在脾脏中有丰富的储存,这种激活可以有效地达到最大程度。释放的内源性TGF-β活性充分激活脾成纤维细胞增殖和增殖产生丰富的胶原蛋白,最终建立有利于肝细胞异位生长的微环境。这些结果揭示了未被充分认识的激活现有GFs的潜力,用于内源性驱动的组织再生。该研究强调了sHA-X通过机械激活单一细胞因子重塑特定器官的功效和转化潜力,代表了一种设计基于生物材料的器官再生疗法的新策略。
原文链接:
https://doi.org/10.1016/j.jhep.2024.01.005