今天,检验君为大家分享的是福建医科大学附属第一医院欧启水教授团队近年来关于慢性乙型肝炎发病机制及生物标志物的研究前沿。
线粒体来源短肽MOTS-c可用于慢性乙型肝炎诊断与治疗
线粒体来源短肽MOTS-c是由线粒体12S rRNA的C末端翻译而来的分泌性短肽,含11~16个氨基酸,具有多种生物活性,包括线粒体信号转导等。此外,线粒体功能与乙型肝炎病毒(HBV)感染息息相关。
2023年,福建医科大学附属第一医院欧启水教授团队的一项研究发现了一种线粒体来源短肽MOTS-c,作为线粒体动力学的调节因子在慢性乙型肝炎诊断与治疗中发挥作用。该研究发表在GUT(IF:24.5,第一作者为林曹瑞博士、罗霖杰硕士和荀振博士)。
该研究对MOTS-c在HBV感染进程中的作用展开研究。首先,研究发现感染HBV后,人体内源性的MOTS-c水平降低,并且MOTS-c的表达与血清HBV DNA水平呈显著负相关。接着,在细胞与动物模型中证明MOTS-c可发挥抗病毒作用及改善肝功能。进一步机制解析表明,这一作用与促进线粒体生物发生密切相关。一方面,MOTS-c通过激活线粒体抗病毒信号蛋白及下游信号通路抑制HBV复制;另一方面,MOTS-c通过MYH9-actin分子马达介导线粒体重塑维持线粒体稳态平衡。
总之,该研究重点强调了线粒体对HBV感染进展的影响,进一步证实了MOTS-c在调节线粒体动力学中的作用,并为HBV感染及其他线粒体相关疾病的诊断和治疗提供了新思路。
牛磺胆酸抑制CHB患者干扰素-α疗效及其机制研究
据统计,全球慢性HBV感染者高达2.96亿。若未及时进行治疗,约有25%的慢性HBV感染者将死于肝硬化或肝癌等疾病。不同慢性乙型肝炎(CHB)患者对聚乙二醇干扰素α(PegIFNα)治疗的应答不同,HBeAg阳性CHB患者采用Peg-IFN-α治疗48周,停药随访24周后,HBV DNA<2000 IU/ml的发生率仅为30%,HBeAg血清学转换率仅为30.75%~36.3%,HBsAg转换率仅为2.3%~3%,表明CHB患者Peg-IFN-α治疗效果有限,但机制尚未完全阐明。
2021年,福建医科大学附属第一医院欧启水教授团队的一项研究表明,牛磺胆酸(TCA)通过损伤CD8+T细胞和NK细胞的功能进而抑制CHB患者的Peg-IFN-α疗效。该研究发表在Cellular & Molecular Immunology(IF:22.1,第一作者为荀振博士)。
该研究旨在探讨胆汁酸在CHB患者Peg-IFN-α疗效中的作用及其调控机制。临床研究发现,慢性HBV感染不同自然史时期的血清胆汁酸谱不同,且胆汁酸(尤其是TCA)的水平越高,HBeAg阳性CHB患者的Peg-IFN-α疗效越差。机制研究发现,TCA通过损伤CD8+T细胞和NK细胞的功能进而抑制IFN-α的免疫调节活性。
该研究提示血清高胆汁酸水平是部分CHB患者IFN-α疗效不佳的原因之一,降低胆汁酸水平有望成为提高CHB患者IFN-α疗效的优化方案,在一定程度上阐明了CHB患者IFN-α疗效差异的原因,并为改善IFN-α对CHB患者的疗效及其预后提供了新的思路。
胆汁酸在慢性乙型肝炎、肝硬化和肝细胞癌中的新作用
胆汁酸(BA)是在肝脏中由胆固醇衍生的两性分子,其主要功能是调节胆固醇代谢、促进胆汁分泌、乳化并促进膳食脂肪的消化吸收;此外,越来越多的证据表明,胆汁酸也可作为内分泌细胞信号介质,激活核或膜定位受体触发特定信号通路并调节各种生物学过程,是肝脏疾病发生发展的关键调节因子。
2023年,福建医科大学附属第一医院欧启水教授团队发表在Cellular & Molecular Immunology(IF:24.1,第一作者为荀振博士和姚小宝硕士)杂志上的Comment对BA在多种肝脏疾病中发挥的作用进行了评述。
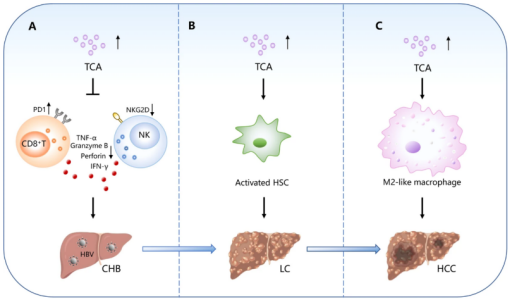
文章提到,不同的胆汁酸以不同的方式在不同的肝脏疾病中发挥双重作用。在CHB患者中,TCA可通过损伤CD8+T细胞和NK细胞的效应功能进而促进HBV复制;在肝硬化中,TCA可通过激活肝星状细胞(HSC)促进肝硬化的发展;在肝细胞癌中,TCA的异常累积可通过激活法尼醇X受体(FXR)促进M2样巨噬细胞极化,形成有利于肿瘤发生的免疫抑制肿瘤微环境,靶向TCA有望是治疗慢性肝脏疾病的新方法。
UDCA约占BA的1%~3%,可加速BA的肠肝循环,通过取代肝脏和肠道内的疏水性的毒性胆汁酸(如TCA)进而发挥肝细胞保护作用并调节免疫反应,防止内源性BA的毒性作用。UDCA单药或与现有一线药物联合是辅助治疗CHB、LC和HCC患者的潜在策略。
HBV促进肝癌发生的新机制
慢性HBV感染可导致CHB、肝硬化或HCC,据报道每年约有一百万人死于HBV相关并发症。HBV基因组包含四个开放阅读框(ORF),其中ORF X编码HBV X (HBx)蛋白。尽管已有报道HBx蛋白与HCC发展密切相关,但其潜在的致癌机制仍不清楚。
2022年,福建医科大学附属第一医院欧启水教授团队的一项研究阐明了HCC患者肿瘤内和非肿瘤组织之间HBV X基因的分区化进化模式,揭示了HBV促进肝癌发生的新机制。该研究发表在Emerging Microbes & Infections(IF:13.2,第一作者为傅亚博士)。
HBV作为准种(QS)存在,HBV X基因突变是HBx致瘤性的关键,而许多突变HBx的功能表型仍然未知。该研究纳入24名HCC和可检测HBV DNA的患者,进行X基因的分子克隆以分析肝组织中单体型的特征。使用稳定表达野生型或突变型HBx的HCC细胞系和皮下肿瘤异种移植小鼠模型用于评估HBx-T81P/S101P/L123S致瘤性。
结果发现,肿瘤组织中HBV QS跨X基因的平均异质性低于非肿瘤组织。与基因型B的克隆相比,在肿瘤组织中基因型为C或D的X基因克隆中观察到位置偏移。基因型C或D克隆中的突变主要聚集在二聚化区和反式激活区内的aa110-aa140。在肿瘤组织中发现了一种新的81、101和123残基突变组合。此外,HBx-T81P/S101P/L123S通过MYC促进细胞增殖并增加基因组不稳定性。
总之,该研究阐明了HCC患者肿瘤内和非肿瘤组织之间HBV X基因的分区进化模式,并为HBV促进肝癌发生提供了一种新的机制,也为监测HCC提供了一个潜在的病毒标志物。
抑瘤素M可抑制HBV复制
CHB是一种常见疾病,虽然少数患者在接受核苷类似物和干扰素治疗后可以实现功能性治愈,但仍有大量患者无法达到这一目标。因此,开发能帮助更多患者实现功能性治愈的治疗方法迫在眉睫。
2023年,福建医科大学附属第一医院欧启水教授团队的一项研究表明,抑瘤素M(OSM)通过JAK-STAT信号诱导IFITM1表达抑制乙型肝炎病毒复制,可作为治疗CHB的潜在疗法。该研究发表在Cellular and Molecular Gastroenterology and Hepatology(IF:7.2,第一作者为叶宇宸博士、傅亚博士和林曹瑞博士)。
该研究首先利用HBV感染的细胞来筛选白细胞介素-6(IL-6)家族细胞因子的抗HBV效力,发现IL-6家族细胞因子中OSM抑制HBV复制的能力最强,酶联免疫吸附试验检测慢性HBV感染患者血清OSM浓度,发现OSM具有作为CHB新型治疗分子的潜能;其次,通过RNA测序、回复实验等方法揭示OSM抗HBV的潜在机制:OSM可激活JAK-STAT信号通路,促进STAT1-IRF9转录因子复合物的形成,进而促进各种已知在先天/适应性免疫中起作用的基因的表达,其中干扰素诱导的跨膜蛋白1差异最为显著,是参与OSM介导的抗HBV效应的重要HBV限制因子;最后,通过小鼠模型来验证OSM体内抑制HBV复制作用,证实OSM可促进干扰素诱导的跨膜蛋白1表达,从而抑制HBV的复制。
总之,该研究表明OSM重塑了针对HBV的免疫应答,具有较强的抗HBV活性,可作为治疗CHB的潜在疗法进一步开发。
代偿性肝硬化和失代偿性肝硬化的鉴别生物标志物
肝硬化是一种常见的慢性肝病,可分为代偿期和失代偿期两种状态。代偿期肝硬化患者的肝功能尚可维持正常,而失代偿期肝硬化患者的肝功能已经严重受损,鉴别诊断代偿性肝硬化和失代偿性肝硬化对于患者后续的治疗有重要意义。
2023年,福建医科大学附属第一医院的欧启水教授团队,利用靶向定量脂质组学和机器学习的方法,发现了一些能够预测代偿期肝硬化和区分失代偿期肝硬化的血脂生物标志物。该研究发表在Clinical Chemistry and Laboratory Medicine(IF:6.8,第一作者为曾勇彬主管技师和张莉硕士)。
该研究分析120名参与者的血清样本,包括90名肝硬化患者(45名代偿性患者和45名失代偿患者)和30名健康人。使用靶向靶向定量脂质组学进行脂质代谢谱分析。应用两种机器学习方法,最小绝对收缩和选择算子(LASSO)、随机森林(RF)来筛选候选代谢物生物标志物。
结果研究人员筛选出了11种脂质代谢物(简称为BMP11),能够有效地预测代偿期肝硬化的存在,其诊断性能的曲线下面积(AUC)为0.944,准确度为94.7%,精确度为95.6%,召回率为95.6%。同时,研究者也筛选出了8种脂质代谢物(简称为BMP8),能够有效地区分失代偿期肝硬化和代偿期肝硬化,其诊断性能的AUC为0.968,准确度为92.2%,精确度为88.0%,召回率为97.8%。
该研究揭示了代偿期和失代偿期肝硬化患者的血清脂质代谢谱的差异,并建立了基于脂质代谢物的肝硬化诊断模型。这些脂质代谢物可能是肝硬化发生和发展的重要参与者,也可能是肝硬化治疗的潜在靶点。
miR-548c-3p抑制CHB患者干扰素-α治疗效果
核苷类似物(NAs)和Peg-IFNα是两种常见的CHB治疗方案,通过不同的药理学机制发挥抗HBV作用。但Peg-IFNα治疗效果存在显著的个体差异,有报道称仅3%~8%的患者实现了HBsAg转换。IFN-α治疗CHB的效果具有局限性,对IFN-α治疗反应个体差异的潜在机制尚不清楚。
2023年,福建医科大学附属第一医院欧启水教授团队的一项研究揭示了miR-548c-3p通过靶向TRIM22,减弱HBeAg阳性CHB患者的Peg-IFNα治疗效果。该研究发表在Antiviral Research(IF=7.3,第一作者为林旎副教授、王隆博士和郭钊培在读博士)。
与NAs相比,干扰素具有治疗时间短、耐药性风险低、血清学反应更高、更持久,并且能够实现HBeAg甚至HBsAg血清转换等优势,但治疗效果个体差异大且机制不清。
研究人员发现干扰素诱导的效应物TRIM22可能是引起这种差异反应的靶点。该研究发现TRIM22在干扰素应答患者中高度表达,且与血清中HBV DNA和HBeAg水平呈负相关。TRIM22过表达的细胞株所携带HBsAg、HBeAg和HBV DNA显著减少,敲低TRIM22后,这些标志物显著升高。生物信息学分析发现TRIM22水平与NOD2/NF-κB通路基因的富集呈正相关,细胞学实验证实TRIM22的高表达可显著提高炎性细胞因子IL-1β和IL-8水平。
该研究还利用TargetScan通过典型的不完全配对,在不同位置鉴定了三种与TRIM22的3′UTR结合的候选microRNA,发现在CHB干扰素应答不佳患者中,MiR-548c-3p高表达,而TRIM22水平较低。miR-548c-3p转染的细胞株中HBsAg、HBeAg和HBV DNA的血清水平升高。荧光素酶报告基因分析证实了miR-548c-3p和TRIM22的3′UTR的靶向关系,可抑制TRIM22内源性表达从而影响干扰素的治疗效果。
该研究表明,内源性miR-548c-3p可以通过负调控TRIM22,减弱HBeAg阳性CHB患者Peg-IFN-α的治疗效果,为IFN-α治疗评估提供了新的标志物和靶点。
CCN1通过α6β1/PI3K/Akt/NF-κB通路加重自身免疫性肝炎
自身免疫性肝炎(AIH)是一种病因不明的慢性炎症性肝病。CCN1作为一种分泌的细胞外基质蛋白,可与不同细胞上不同类型的整合素分子结合,发挥不同的作用。已有大量研究表明,CCN1在肝脏的发病机制中也有重要作用。
2022年,福建医科大学附属第一医院欧启水教授团队的一项研究揭示了CCN1在AIH中的促炎作用及下游信号通路,证实CCN1通过α6β1/PI3K/Akt/NF-κB通路加重AIH。该研究发表在Frontiers in Immunology(IF=7.3,第一作者为江仁权在读博士)。
该研究收集了59名AIH患者、26名原发性胆管炎(PBC)患者、22名重叠综合征(OS)患者以及68名健康人员的临床样本和数据。采用实时聚合酶链反应、蛋白质印迹和免疫组织化学方法检测CCN1在肝脏中的表达。ELISA法检测血清CCN1水平。通过受试者工作特性(ROC)曲线分析确定CCN1的诊断价值。
结果发现CCN1在AIH患者的肝细胞中过度表达。与健康对照组相比,AIH患者血清中CCN1水平也增加。ROC曲线分析结果表明,血清CCN1能够区分AIH患者。通过构建CCN1基因条件敲除(CCN1fl/flCre+)小鼠,发现CCN1基因敲除后ConA诱导的小鼠肝损伤减轻,表明CCN1在炎症发生中发挥作用。随后利用人肝细胞系LO2细胞研究了CCN1对IL-6的影响,结果表明,CCN1敲除后可通过降低ALT/AST水平和IL-6表达。此外,该研究发现CCN1可以通过与α6β1受体结合,通过PI3K/Akt/NF-κB信号通路激活IL-6的产生。
总之,该研究表明,CCN1可能通过α6β1/PI3K/Akt/NF-κB信号通路诱导IL-6产生,从而促进AIH的发生,靶向CCN1可能是治疗AIH的一个潜在的治疗策略。
血清ATP或为鉴别CHB进展的生物标志物
若没有及时有效的治疗,CHB可进展为肝硬化甚至HCC,而现有的抗病毒治疗并不能防止肝硬化和HCC发生。因此,定期监测病情进展对CHB患者的病情评估和用药指导具有重要意义。
日前,福建医科大学附属第一医院欧启水教授团队的一项研究指出,ATP与HBV病毒感染进展相关,或能为CHB患者疾病进展程度提供新的诊断指标和预测指标。该研究发表在Frontiers in Immunology(IF=7.3,第一作者为林曹瑞博士)。
该研究纳入177名受试者,包括40名健康对照和137名HBV感染患者,基于慢性HBV感染的自然史将患者分为四个阶段:HBeAg阳性的慢性HBV感染、HBeAg阳性CHB、HBeAg阴性的慢性HBV感染和HBeAg阴性CHB。
通过检测HBV感染人群血清中的ATP水平,验证血清ATP作为不同HBV感染进展的潜在标志物的诊断价值,发现与健康对照组相比,CHB患者血清中的ATP水平显著降低。但疾病进展到肝硬化、HCC将诱导血清ATP水平适度升高,特别是在HCC患者中,与健康对照组并无区别。
为了确定HBV感染过程中患者的血清ATP水平的表达,研究人员对来自HBV感染的四个不同疾病阶段的患者进行研究,结果表明,在HBV感染和相关肝病进展的不同阶段,血清ATP水平确实存在差异。随后通过HBV感染细胞和小鼠模型也证实了ATP在HBV感染相关疾病恶化中的作用。
总之,该研究结果表明,HBeAg阳性CHB患者血清ATP水平明显低于健康对照组。在CHB发展为肝硬化和肝细胞癌的过程中,ATP水平升高,但并不高于健康对照组。血清ATP区分HBeAg阳性CHB与健康对照的曲线下面积(AUC)为0.9063,而鉴别CHB与HCC的AUC为0.8328。对其机制的初步探讨表明,CHB患者血清ATP下降是由于线粒体受损所致。
研究人员表示,血清ATP与CHB的进展密切相关,或将成为区分HBeAg阳性CHB患者和健康人群潜在的生物标志物。