2023年1月10日,空军军医大学张芳琳、雷迎峰、徐志凯、张西京共同通讯在Nature Communications 发表题为“Disparate macrophage responses are linked to infection outcome of Hantan virus in humans or rodents”的研究论文,该研究表明鼠源及人源巨噬细胞对HTNV感染反应性的差异决定其对机体炎症的调控作用不同,与HTNV感染致病关系密切。
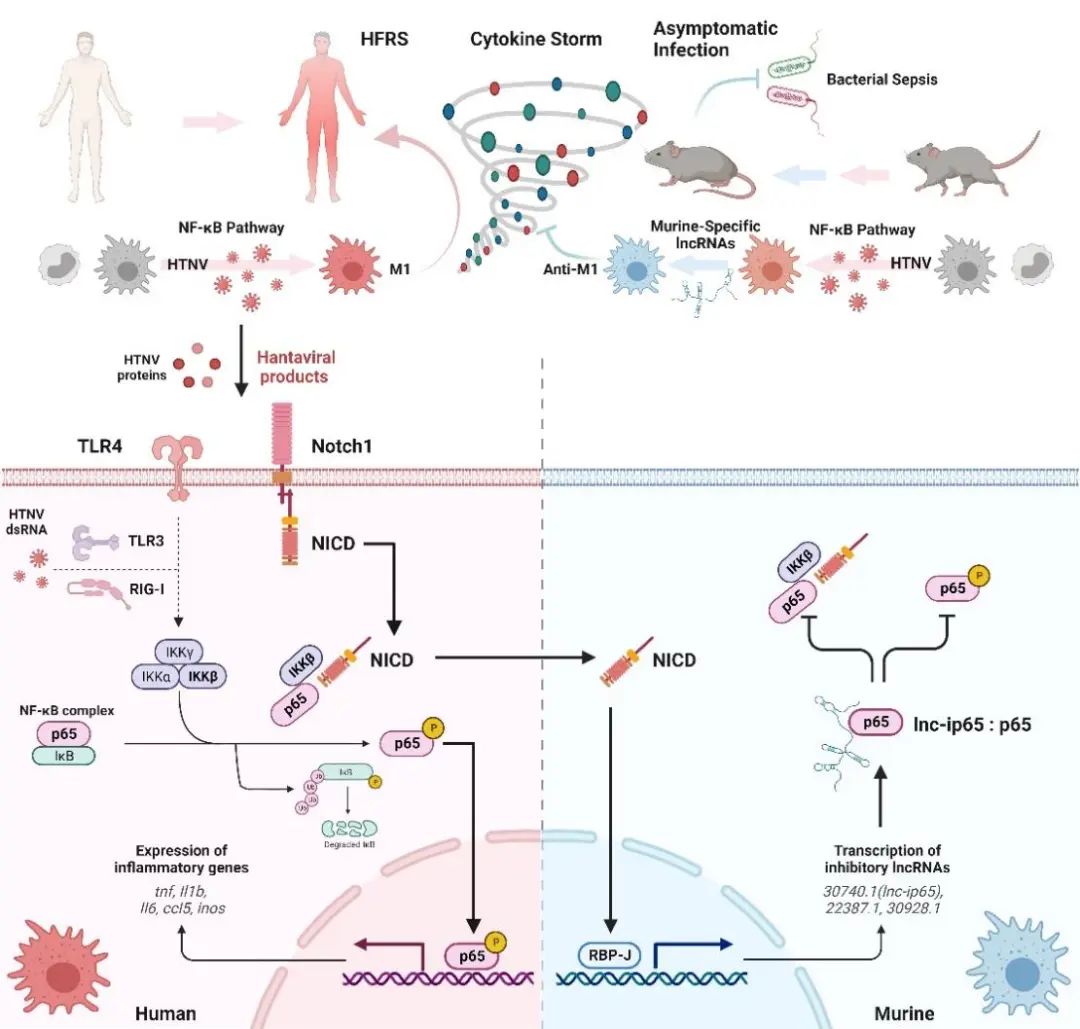
进一步研究显示,感染早期病毒核衣壳蛋白(NP)激活Notch—NF-κB通路使得鼠源/人源巨噬细胞发生M1活化,促进炎症进展;在感染后期,人源巨噬细胞表现为持续活化,而鼠源巨噬细胞可通过Notch—Lnc-ip65—p65轴抑制p65磷酸化,避免M1持续活化而引起过度炎症反应。本研究从长非编码RNA(LncRNA)角度阐释了鼠源/人源巨噬细胞对HTNV反应性差异的分子机制,明晰了鼠源/人源巨噬细胞对HTNV反应性差异发病机制的理论依据,也为HTNV感染提供了一种特殊的治疗策略。
汉坦病毒(HTNV)是在世界上分布广、传播途径多、危害极其严重的出血热病毒,感染人体可引起肾综合征出血热(HFRS),以血管内皮损伤及通透性增加为基本病理表现,发病机制与机体过度炎症反应及其产生的细胞因子风暴关系密切。但自然界中的宿主动物,如黑线姬鼠、褐家鼠等啮齿类动物感染 HTNV后可以长期携带病毒但不发病,其潜在机制仍有待阐明。巨噬细胞在机体抗病毒免疫应答过程中发挥关键作用,是连接宿主固有和适应性免疫应答的桥梁,也是调控机体炎症反应、维持免疫稳态的重要因素。巨噬细胞在感染过程中存在M1和M2两种可以相互转化的活化模式,前者主要在疾病急性期发挥作用,可促进炎症发生和进展,利于病原清除但加重免疫损伤;后者主要在疾病恢复期/疾病慢性化过程中发挥作用,可抑制炎症反应、促进组织修复但不利于病原清除。
本研究探究了巨噬细胞活化模式与HFRS疾病进展的关系,流式细胞术等结果显示HFRS 疾病早期,M1活化比例显著增加且与疾病严重程度正相关,人源以TNF-α为核心的促炎巨噬细胞过度活化是HTNV感染所致细胞因子风暴及血管内皮功能紊乱的重要因素,鼠源巨噬细胞的促炎表型(M1)则表现为先激活后抑制。提示鼠源及人源巨噬细胞对于HTNV感染反应性的差异及其不同活化模式对炎症反应的调控作用。
文章模式图(图源自Nature Communications )
Notch 信号是进化中高度保守的信号途径,其调控巨噬细胞活化的机制也逐步被揭示。当Notch受体受到相应配体刺激后,其胞内活化片段NICD从细胞膜内侧释放并进入核内。NICD入核后与转录因子RBP-J相互作用,从而调节基因表达。NF-κB家族中的p65是巨噬细胞活化的关键转录因子,p65-p50组成的异源二聚体活化后可以促进TNF-α、IL-6等炎性细胞因子或趋化因子产生。在感染条件下,巨噬细胞中模式识别信号活化,其通过多种方式激活IκB激酶复合物,IKK-β可促进IκB-α磷酸化并降解,解除IκB-α对p65-p50的抑制作用。
本研究发现HTNV感染早期,NICD在胞浆中积累,其与p65和IKK-β相互作用促进p65磷酸化,进而促进M1活化。然而在小鼠中,NICD在感染晚期易位进入细胞核并诱导各种鼠特异性LncRNA表达。其中,Lnc-ip65与NICD竞争结合p65并抑制p65磷酸化,扭转巨噬细胞促炎表型。这些结果为汉坦病毒致病机制提供了新观点,揭示了LncRNA在阻断巨噬细胞多度炎症反应中的免疫功能,为HFRS和其他炎症性疾病提供了潜在的治疗策略。
空军军医大学医学院张芳琳课题组的讲师马宏炜、硕士研究生杨永恒、唐都医院实验外科讲师乜铁建为本文的共同第一作者,空军军医大学基础医学院的张芳琳教授、雷迎峰教授、徐志凯教授和空军军医大学西京医院的张西京教授为本文的共同通讯作者。
参考消息:
https://doi.org/10.1038/s41467-024-44687-4