2024年1月12日,中山大学刘华山、康亮及Xing Yue共同通讯在Nature Communications发表题为“Mutant KRAS-activated circATXN7 fosters tumor immunoescape by sensitizing tumor-specific T cells to activation-induced cell death”的研究论文,该研究报告了来自KRASMUT肿瘤的肿瘤特异性细胞毒性T淋巴细胞(CTL)对活化诱导细胞死亡(AICD)敏感。circATXN7是一种NF-κB相互作用的环状RNA,通过使NF-κB 失活来控制T细胞对AICD的敏感性。机制上,来源于KRASMUT肿瘤细胞产生的乳酸的组蛋白乳糖化直接激活circATXN7的转录,circATXN7与NF-κB p65亚基结合,并掩盖p65核定位信号基序,从而将其隔离在细胞质中。
在临床上,肿瘤特异性CTL中circATXN7的上调与不良临床结局和免疫治疗耐药相关。CD8+T细胞中circAtxn7的基因敲除导致突变选择性肿瘤抑制,同时还增加了雌性小鼠多种肿瘤模型中的抗PD1疗效。此外,在过继转移的肿瘤反应性CTL中靶向circATXN7可提高其抗肿瘤活性。这些发现为淋巴细胞表达的circRNA如何促进T细胞命运决定和抗癌免疫治疗提供了见解。
人类KRAS蛋白既是朋友又是敌人;非突变型在不同的生理过程中是必不可少的,而突变型直接参与了肿瘤发生和发展的多步骤过程,约占所有癌症的30%。靶向KRAS被认为是对抗KRAS驱动的肿瘤和改善晚期癌症患者预后的最佳策略之一。尽管KRAS抑制剂取得了进展,但数十年的努力并未将其带入临床。最近的研究表明,突变型的KRAS可以被癌症利用来协调免疫抑制肿瘤微环境(TME)。癌症基因组图谱还表明,KRAS突变型结直肠癌(CRC)与免疫浸润和反应性降低密切相关。此外,KRAS抑制使肿瘤的抗肿瘤免疫力显着增加。因此,KRAS突变肿瘤尤其具有免疫排斥性,旨在激活抗肿瘤免疫程序的治疗方法对于消除该疾病可能至关重要。
癌症病理通常由各种代谢物协调,KRAS突变肿瘤尤其暴露于乳酸水平急剧升高。目前的研究也产生了证据表明,TME中的乳酸是提供有效抗肿瘤免疫的障碍。在这方面,研究发现肿瘤来源的乳酸对肿瘤相关巨噬细胞、 调节性T细胞、髓源性抑制细胞、 自然杀伤细胞或树突状细胞起作用。特别是,Kreutz及其同事指出了乳酸对细胞溶解性T淋巴细胞(CTL)的影响,在癌症免疫监测过程中直接识别和破坏新生肿瘤细胞。之前的研究显着提高了对乳酸参与CTL命运决定的理解,并随后支持肿瘤进展。这些见解强调了乳酸和CTL之间的密切结合,但乳酸在CTL中作用的细胞内机制仍然不明确。
活化诱导细胞死亡(AICD)于1987年首次被描述,其特征是与免疫稳态的机制联系。在生理条件下,AICD能够根除被认为不再需要的活化T淋巴细胞。AICD在病毒感染、炎症和自身免疫性疾病等多种病理状态下均有异常。在许多癌症类型的背景下,AICD的失调也经常被发现。现在人们普遍认为,AICD对于破译癌症病理学以及提供预后见解,甚至为癌症患者开发替代疗法具有重要价值。沿着这条路线,之前发现表达CRC细胞的突变型KRAS利用肿瘤来源的乳酸使肿瘤特异性CTL对AICD敏感,从而促进肿瘤免疫逃逸和免疫治疗耐药性。研究发现多种分子机制参与了肿瘤特异性CTL对AICD的异常敏感性。尽管如此,乳酸如何重编程肿瘤特异性CTL的AICD仍需进一步研究。
环状RNA(circRNA)是一类独特的RNA分子,其特征在于其共价闭环结构。由于一些特殊的特征,提高了对研究circRNA的兴趣,但最重要的是,因为它们的失调表达与许多病理状况有关。越来越多的数据表明,这些分子具有潜在的临床相关性和实用性。值得注意的是,circRNA已被确定为肿瘤免疫调节网络的参与者。Wang及其同事证明,hsa_circ_0020397在CRC细胞中的过表达可以通过结合和抑制miR-138表达来促进PD-L1的上调,从而导致肿瘤免疫逃逸。此外,有证据表明circRNA与几种癌症中的免疫细胞浸润之间存在相关性。这些进展强调了circRNA与癌症免疫学之间的联系,但对circRNA所起作用以及circRNA在CTL中的作用机制的了解有限。
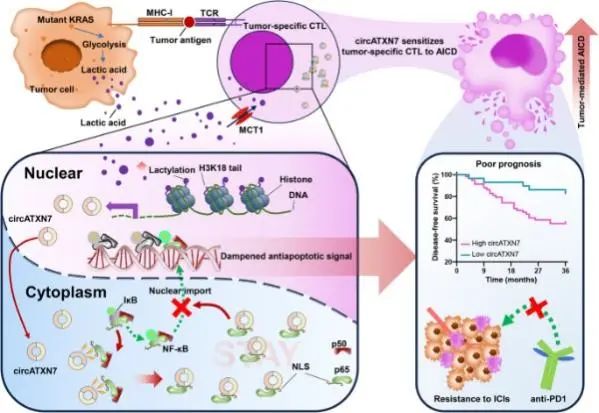
文章模式图(图源自Nature Communications )
该研究表明肿瘤介导的AICD可以被致癌KRAS利用,以决定免疫抑制肿瘤微环境的形成。在KRASMUT结直肠癌的肿瘤特异性CTL中,组蛋白乳糖化启动circATXN7的转录,circATXN7是一种与NF-κ b相互作用的环状RNA。circATXN7 的上调通过与 NF-κB p65 亚基结合并掩盖p65核定位信号基序,从而将其隔离在细胞质中,从而增加肿瘤特异性 CTL 对 AICD 的敏感性。在KRASMUT荷瘤小鼠中,CD8+ T细胞中circAtxn7的基因敲除导致突变选择性肿瘤抑制,同时也提高了抗PD1疗效。给予circATXN7敲低的肿瘤反应性CTL,通过改善NOD中CRC患者来源的异种移植中CTL的积累,有效地抑制肿瘤生长。SCID小鼠。在临床上,肿瘤特异性CTL中circATXN7的增加与不良临床结局和免疫治疗耐药相关。总之,研究结果强调了环状RNA在T细胞命运决定中的重要性,并提示在T细胞中改造环状RNA代表了一种可开发的抗肿瘤免疫治疗方法。
参考消息:
https://doi.org/10.1038/s41467-024-44779-1