2023年12月7日,英国伦敦大学 Christopher J. Tape团队在Cell 在线发表题为“An oncogenic phenoscape of colonic stem cell polarization”的研究论文(该文章入选为封面文章),该研究发现细胞命运可塑性失调是结肠肿瘤发生的标志,细胞可以通过致癌和基质信号传导的组合快速穿越结肠分化表型。该研究对1107种结肠类器官培养物进行了系统的单细胞分析,这些培养物受:(1)结直肠癌(CRC)致癌突变、(2)微环境成纤维细胞和巨噬细胞、(3)基质配体和(4)信号抑制剂的调节。
多重单细胞分析揭示了由癌基因和基质配体组合决定的逐步上皮分化现象,从成纤维细胞诱导的群集素(CLU)+再生结肠干细胞(revCSCs)到癌基因驱动的LRIG1+超增殖CSCs (proCSCs)。从revCSCs到proCSCs的转变是通过减少WNT3A和TGF-β驱动的YAP信号和增加KRASG12D或基质EGF/Epiregulin激活的MAPK/PI3K通量来调节的。总之,APC缺失和KRASG12D共同限制了对revCSCs的访问,并破坏了proCSC命运中的间质-上皮通讯捕获上皮。这些结果表明,致癌突变通过阻碍细胞命运可塑性的细胞外源调节来主导稳态分化。
另外,2023年12月7日,范德比尔特大学Ken S. Lau及Robert J. Coffey共同通讯在Cell 在线发表题为“Molecular cartography uncovers evolutionary and microenvironmental dynamics in sporadic colorectal tumors”的研究论文,该研究提出了以患者为中心的 CRC 演变和进展图谱,该图谱是通过对一组独特且异质的人类 CRC 标本进行综合、图谱范围的分析而产生的。该研究对31例人类结直肠标本的空间多组学数据进行分析,实现了肿瘤进化的系统地理定位,揭示了个体化的进展轨迹以及伴随的微环境和克隆变化。系统地理图谱对遗传事件进行排序,根据肿瘤的进化动力学对其进行分类,并沿着包含染色体不稳定性(CIN+)和超突变(HM)途径的全球伪时间进展轨迹放置克隆区域。综合单细胞和空间转录组学数据显示,随着时间的推移,复发性上皮程序和浸润性免疫状态。该研究发现了一个免疫排斥特征(IEX),由细胞外基质调节剂DDR1、TGFBI、PAK4和DPEP1 组成,它与CIN+肿瘤进展有关,与细胞毒性细胞浸润减少有关,并在独立队列中显示预后价值。该空间多组学图谱提供了对结直肠肿瘤微环境共同进化的见解,可作为分层和靶向治疗的资源。
2023年12月7日,英国伦敦大学 Christopher J. Tape、美国耶鲁大学Smita Krishnaswamy共同通讯在Cell 在线发表题为“Trellis tree-based analysis reveals stromal regulation of patient-derived organoid drug responses”的研究论文,该研究利用一种名为Trellis的方法揭示了患者来源的类器官药物反应的基质调节。该研究开发了一个高度多路复用的细胞计数平台,以单细胞分辨率测量 > 2500个结直肠癌(CRC) PDOs和癌症相关成纤维细胞(CAFs)对临床治疗的反应,测量翻译后修饰(PTM)信号、DNA损伤、细胞周期活性和凋亡。为了在数千个单细胞数据集中比较患者和微环境特异性药物反应,该研究开发了“Trellis”,一种高度可扩展的、基于“树”的治疗效果分析方法。Trellis单细胞筛选显示靶细胞周期阻滞和DNA损伤药物效应是常见的,即使在化疗难治性PDOs中也是如此。然而,药物诱导的细胞凋亡是罕见的,患者特异性的,并且与癌细胞PTM信号一致。该研究发现CAFs可以调节PDO可塑性转移的增殖性结肠干细胞(proCSCs)到缓慢循环的再生性结肠干细胞(revCSCs),以保护癌细胞免受化疗的影响。
综上,Cell 三文连发揭示了结肠癌的“致癌因子”与化疗“保护伞”,这为结肠癌的分类、发现和治疗提供了可靠的科学依据和治疗方向。



肠上皮包括多种细胞类型,具有营养吸收、废物清除和屏障保护等功能。在健康的结肠中,一个上皮细胞亚群通过胞包间充质生态位维持多能干细胞状态。间质成纤维细胞分泌旁分泌配体,包括WNT、表皮生长因子(EGF)、Noggin和R-Spondin-1,以维持上皮的干性,并引导沿隐窝向分泌和吸收谱系分化。在结直肠癌(CRC)中,靶向APC、KRAS、BRAF、SMAD4和/或P53细胞的致癌突变可自主诱导CRC细胞中的隐窝祖细胞表型。因此,在健康的结肠和结直肠癌中,一个上皮细胞亚群维持在干细胞样状态,尽管通过不同的机制。
结肠上皮干细胞传统上被描述为LGR5+ OLFM4+隐窝基祖细胞。然而,最近对肠上皮的单细胞研究发现了额外的多能细胞类型,最著名的是Clusterin (CLU)+ ANXA1+再生干细胞可以在组织损伤后被诱导重新填充所有上皮细胞类型,但在体内平衡的肠道中很少。复苏样干细胞也与结直肠癌的发生有关,可以在发展的结直肠癌肿瘤中以患者特异性的方式观察到,并且正在作为假定的耐药持续性(DTP)细胞出现在结直肠癌中。然而,致癌信号和微环境信号的组合如何调节上皮细胞向传统或再生干细胞的分化尚不清楚。
Cell 封面文章
结直肠癌肿瘤微环境(TME)是一个异细胞系统,其中细胞内在致癌突变和细胞外源性基质信号共同调节上皮癌细胞。基质配体和致癌突变可以激活结肠上皮细胞内常见的信号通路。例如,基质WNT/R-Spondin-1配体和APC-loss都会过度激活经典β-catenin信号,而EGF和KRAS/BRAF突变则会刺激丝裂原活化蛋白激酶(MAPK)途径。由于它们重叠的信号机制,在肿瘤发生过程中,致癌突变必须与基质配体竞争,然而,细胞内在和外在信号如何共同调节上皮细胞的命运仍然是难以捉摸的。
该研究描述了一项功能性单细胞研究,探索细胞外源性和细胞内在线索如何共同调节结肠上皮细胞的命运。利用单细胞RNA测序(scRNA-seq)和高度多路巯基反应性类器官原位编码(TOBis)质粒细胞术(MC)对超过1000个异细胞类器官培养物进行平行扰动分析,发现成纤维细胞和致癌突变诱导结肠上皮细胞不同的上皮干细胞结局。该研究发现成纤维细胞通过转化生长因子β1 (TGF-β1)和YAP将上皮细胞极化为慢循环CLU+复苏干细胞,而APC缺失、KRASG12D和/或外源性表调节蛋白(EREG)将细胞转向LRIG1+超增殖,这依赖于磷脂酰肌醇3-激酶(PI3K)信号传导。
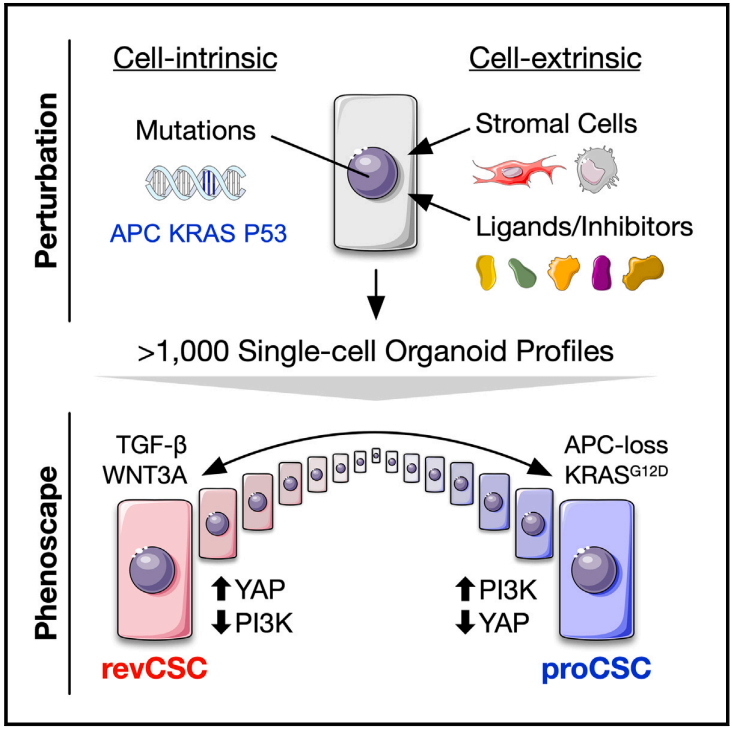
文章模式图(图源自Cell )
APC缺失和KRASG12D通过阻断间质-上皮间的通讯,共同阻断上皮可塑性的细胞外源性调节,使CRC细胞处于癌性状态。尽管癌基因在上皮可塑性上占主导地位,但该研究发现CRC细胞仍然可以进入恢复干细胞样状态,但这需要TGF-β1在PI3K信号减少的同时高度激活YAP。这些结果表明,结肠上皮干细胞存在连续分化现象,其中致癌突变和基质线索竞争上皮身份,但癌基因最终通过阻断细胞命运可塑性的基质调节而占主导地位。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(23)01221-7
https://www.cell.com/cell/fulltext/S0092-8674(23)01222-9
https://www.cell.com/cell/fulltext/S0092-8674(23)01220-5