2023年11月15日,徐州医科大学江苏省免疫与代谢重点实验室闫居明教授团队在国际权威杂志美国科学院院刊Proceedings of the National Academy of Sciences of the United States of America (PNAS ) 在线发表题为”NMDAR antagonists suppress tumor progression by regulating tumor-associated macrophages“的研究成果,该研究发现NMDAR在调节肝癌和成纤维细胞瘤肿瘤微环境(TME)中的巨噬细胞功能中发挥重要作用。结合多学科实验技术,包括神经受体信号、免疫学、代谢及单细胞测序等多组学分析等技术 ,揭示了TME中NMDAR调节肿瘤相关巨噬细胞功能和代谢的机制。
在TME中,NMDAR在巨噬细胞中的表达被上调,NMDAR被激活后引发钙离子流入,下游CaMKII/ERK/CREB通路被激活;巨噬细胞氧化磷酸化代谢增强、ROS水平上升、线粒体结构被破坏,导致肿瘤相关巨噬细胞(TAMs)的免疫抑制功能增强。NMDAR拮抗剂能有效解除TAMs细胞介导的免疫抑制,促进T细胞和自然杀伤(NK)细胞介导的抗肿瘤免疫应答。值得注意的是,NMDAR拮抗剂美金刚、酒石酸艾芬地尔等临床药物显著抑制肿瘤的发展,同时,NMDAR拮抗剂与抗PD-1抗体联合治疗能够显著提高免疫检测点阻断抗体的疗效。该研究为治疗神经相关疾病临床药物用于肿瘤免疫治疗提供了理论依据,具有重要的临床意义。
免疫抑制性肿瘤微环境是肿瘤免疫逃逸和免疫治疗药物失败的根本原因之一。阻断抑制性免疫检查点如PD-1抗体等免疫治疗在临床治疗中取得了一定成功。然而,很多病人不响应这些免疫治疗或产生耐药。因此,解除免疫抑制性肿瘤微环境对于开发更有效的免疫疗法至关重要。
NMDAR在神经相关领域已得到最广泛而深入的研究,在多种病理生理过程中发挥重要作用并已成多种疾病治疗的靶点。然而,目前NMDAR在肿瘤微环境中对巨噬细胞的调节作用尚不清楚。研究人员发现,NMDAR 在TME 中的激活改变了巨噬细胞的功能和代谢改变,并增强了免疫抑制因子的表达,从而导致肿瘤免疫逃逸。NMDAR是细胞内关键信号分子钙离子的通道,由两个基本亚基NR1和两个调节亚基(NR2A/B/C/D,NR3A/B)构成的一种异源四聚体蛋白,其中NR1亚基是钙传导所必需的。谷氨酸和 N-甲基-D-天冬氨酸(NMDA)是 NMDAR 的天然激动剂,与NMDAR的结合导致离子通道的开放,允许钙离子和钠离子的流入以及钾离子的流出。
本研究阐明,在TME中,NMDAR在巨噬细胞中的表达被上调。肿瘤细胞培养上清中检测到大量谷氨酸能够激活小鼠骨髓来源巨噬细胞(BMDMs)上NMDAR并促进钙离子内流,增强巨噬细胞免疫抑制分子,如Arg1、TGFβ的表达。值得注意的是,NMDAR被激活后引发钙离子大量流入,通过下游激酶 CaMKII 和 ERK1/2 以及转录因子 CREB 的激活作用调控巨噬细胞功能。同时,在巨噬细胞代谢方面,发现NMDAR激活导致巨噬细胞氧化磷酸化代谢增强、ROS水平上升、线粒体结构被破坏,TAMs的免疫抑制功能增强。阻断 NMDAR 可抑制 ROS 的产生和细胞毒性作用,包括脂质过氧化和线粒体结构损伤。
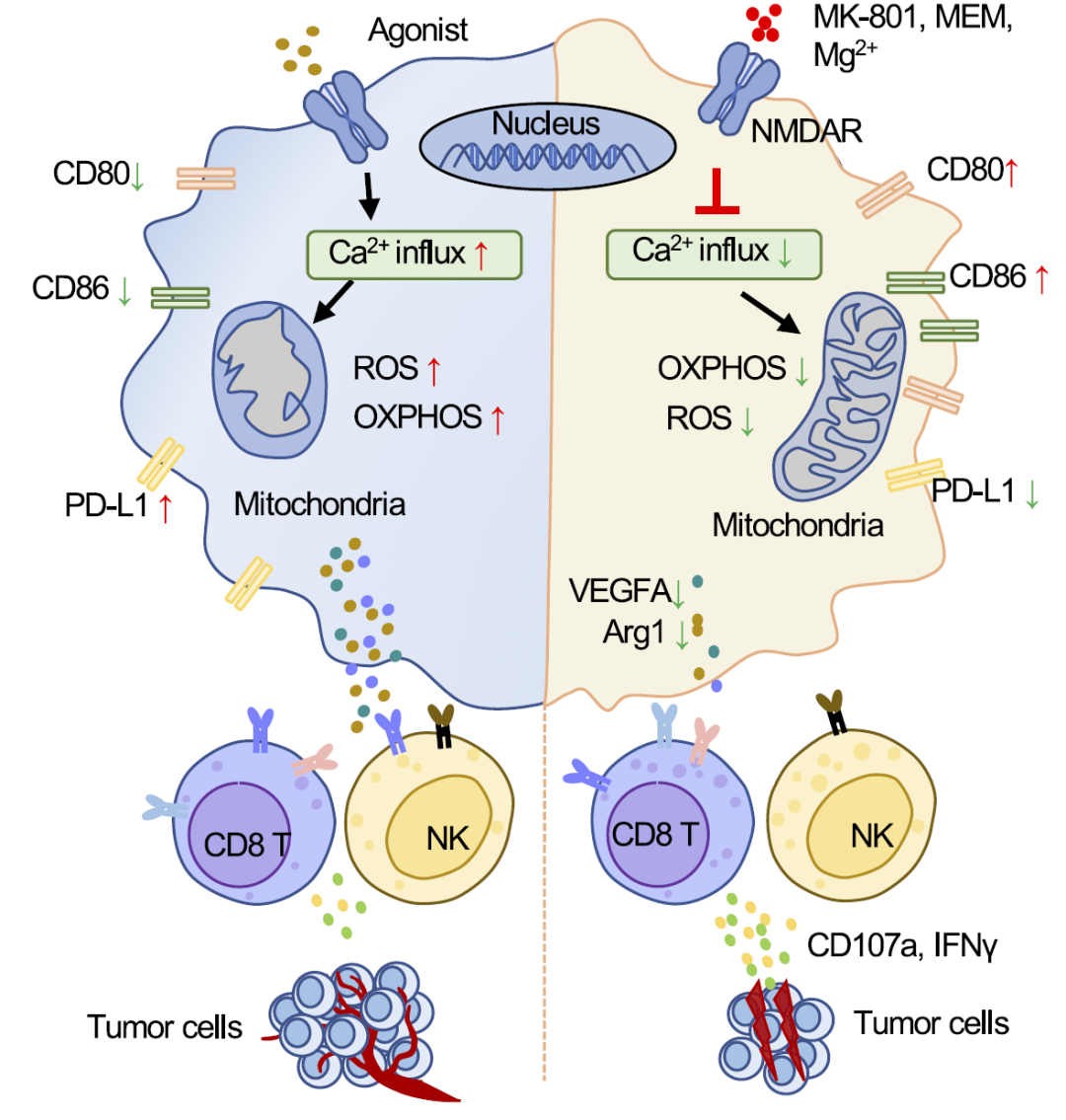
机理模式图(图源自PNAS )
在体内,使用NMDAR拮抗剂如地佐西平(MK-801)和美金刚(MEM)阻断显著降低了 TAMs 的免疫抑制功能,促进T细胞和自然杀伤(NK)细胞介导的抗肿瘤免疫应答,显著抑制了小鼠肿瘤模型中的肿瘤进展。引人注目的是,在抗 PD-1抗体治疗中加入 NMDAR 拮抗剂可显著改善肿瘤进展,超过 65% 的小鼠实现了完全排斥。这些发现共同表明,靶向 NMDAR 以改变 Ca2+ 信号通路和代谢是提高抗 PD-1 免疫疗法疗效的一种潜在方法。
该研究报道了NMDAR在肝癌和成纤维细胞瘤肿瘤微环境中,NMDAR过度激活引发钙离子流入和活性氧产生,从而促进TAMs的免疫抑制功能增强。使用NMDAR拮抗剂MK-801、美金刚解除了TAMs的免疫抑制,促进T细胞和自然杀伤(NK)细胞介导的抗肿瘤免疫反应。更重要的是,NMDAR拮抗剂与抗PD-1抗体联合治疗显著提高免疫检测点阻断抗体的疗效。为靶向NMDAR的肿瘤免疫疗法提供了理论依据。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2302126120/