2023年11月22日,芝加哥大学陈靖、何川、圣裘德儿童研究医院迟洪波共同通讯在Nature 在线发表题为“Trans-vaccenic acid reprograms CD8+ T cells and anti-tumour immunity”的研究论文,该研究发现反式异油酸(TVA)能够重编程CD8+ T细胞和抗肿瘤免疫。TVA是富含母乳中的反式脂肪酸的主要形式,但人体不能内源性地产生TVA。人类循环TVA主要来自反刍动物来源的食物,包括牛肉、羊肉和奶和黄油等乳制品,但只有大约19%或12%的膳食TVA分别被人类或小鼠转化为瘤胃酸。
从机制上讲,TVA 使细胞表面受体GPR43失活,GPR43是一种由其短链脂肪酸配体激活的免疫调节性G蛋白偶联受体。因此,TVA 拮抗GPR43的短链脂肪酸激动剂,导致cAMP-PKA-CREB轴的激活,从而增强CD8+ T细胞功能。这些发现表明,饮食衍生的 TVA 代表了CD8+ T细胞宿主外源性重编程的机制,而不是宿主内肠道微生物群衍生的短链脂肪酸。因此,TVA具有治疗肿瘤的转化潜力。
另外,2023年11月15日,圣裘德儿童研究医院迟洪波团队(周培培、史豪及黄宏龄为共同第一作者)在Nature 在线发表题为“Single-cell CRISPR screens in vivo map T cell fate regulomes in cancer”的研究论文,该研究使用单细胞CRISPR筛选系统地绘制了体内的因果基因调控网络,并发现了CTL分化的检查点。,该研究表明,促进Tpex细胞退出静止状态和丰富增殖的Tex细胞状态是抗肿瘤作用的关键模式,并为整合细胞命运规则和癌症免疫的可重编程功能决定因素提供了系统框架。
2023年8月30日,加州大学圣地亚哥分校Ananda W. Goldrath及圣裘德儿童研究医院迟洪波等团队合作在Nature 在线发表题为“Metabolic programs of T cell tissue residency empower tumour immunity”的研究论文,该研究发现记忆性CD8+ T细胞部署了一系列适应组织驻留,包括依赖于甲羟戊酸-胆固醇途径的非甾体产物,如辅酶Q,由转录因子SREBP2活性增加驱动。这种代谢适应在小肠中最为明显,在小肠中,TRM细胞与膳食胆固醇结合并保持高度激活状态,并且在小鼠和人类的不同肿瘤类型中,功能性肿瘤浸润淋巴细胞也共享这种适应。通过删除Fdft1或过表达PDSS2来加强辅酶Q的合成,可以促进线粒体呼吸、病毒感染后记忆T细胞的形成和增强抗肿瘤免疫。总之,通过对TRM细胞代谢的系统探索,该研究揭示了这些程序如何在急性感染的背景下促进记忆性CD8+ T细胞的形成并增强抗肿瘤免疫。
2023年7月5日,圣裘德儿童研究医院迟洪波团队在Nature 在线发表题为“SLC38A2 and glutamine signalling in cDC1s dictate anti-tumour immunity”的研究论文,该研究建立了谷氨酰胺作为细胞间代谢检查点,它指示肿瘤-cDC1串扰并允许cDC1激活细胞毒性T细胞的功能。该研究结果证实了谷氨酰胺介导的肿瘤细胞和cDC1s之间的细胞间代谢串扰是肿瘤免疫逃避的基础,并揭示了cDC1s中的谷氨酰胺获取和信号传导是DC激活的限制事件和癌症治疗的假定靶点。
2022年6月22日,圣裘德儿童研究医院Douglas R. Green及迟洪波共同通讯在Nature 在线发表题为“cBAF complex components and MYC cooperate early in CD8+ T cell fate”的研究论文,该研究使用基于 CRISPR 的筛选体内 Tmem 细胞生成的负调节因子,鉴定了哺乳动物经典 BRG1/BRM 相关因子 (cBAF) 的多个成分。cBAF 复合物的几种成分对于活化的 CD8+ T 细胞分化为 T 效应 (Teff ) 细胞至关重要,它们的缺失促进了体内 Tmem 细胞的形成。在活化的 CD8+ T 细胞第一次分裂期间,cBAF 和 MYC 经常不对称地与两个子细胞共配。具有高 MYC 和高 cBAF 的子细胞显示出向 Teff 细胞的细胞命运轨迹,而具有低 MYC 和低 cBAF 的子细胞优先向 Tmem 细胞分化。cBAF 复合物和 MYC 物理相互作用以在活化的 CD8+ T 细胞中建立染色质景观。在产生嵌合抗原受体 T (CAR-T) 细胞之前,在激活的前 48 小时内,用推定的 cBAF 抑制剂治疗幼稚 CD8+ T 细胞显著提高了小鼠实体瘤模型的疗效。总之,该研究结果将 cBAF 确立为 Tmem 细胞命运的负决定因素,并表明在 T 细胞分化早期操纵 cBAF 可以改善癌症免疫治疗。
2021年11月18日,圣裘德儿童研究医院迟洪波团队在Nature 在线发表题为“CRISPR screens unveil signal hubs for nutrient licensing of T cell immunity”的研究论文,该研究使用全基因组 CRISPR 筛选结合蛋白质 - 蛋白质相互作用网络来识别调节模块,这些模块在小鼠调节性 T (Treg) 细胞中介导免疫受体和营养依赖性信号传导至 mTORC1。该研究结果建立了表观遗传和翻译后机制,这些机制支持营养转运蛋白及传感器如何与免疫信号相互作用以对 mTORC1 活性进行三级调节,并确定它们在许可 T 细胞免疫和免疫耐受方面的关键作用。
2021年7月7日,美国圣裘德儿童研究医院迟洪波团队在Nature 发表题为“Metabolic control of TFH cells and humoral immunity by phosphatidylethanolamine”的研究论文,该研究表明胞苷二磷酸 (CDP)-乙醇胺途径协调 CXCR5 的表达和定位与 TFH细胞的反应和体液免疫。在小鼠体内使用 CRISPR-Cas9 筛选和功能验证,该研究确定 ETNK1、PCYT2 和 SELENOI作为 TFH细胞分化的选择性转录后调节剂,通过促进 CXCR5 的表面表达和功能作用发挥作用。TFH 细胞表现出独特的脂质代谢程序,PE 分布在质膜的外层,与 CXCR5 共定位。通过 CDP-乙醇胺途径从头合成 PE 协调这些事件以防止 CXCR5 的内化和降解。活化 T 细胞中 Pcyt2 而非 Pcyt1a(介导 CDP-胆碱途径)的基因缺失会损害 TFH 细胞的分化,这与体液免疫反应降低有关。B 细胞上 PE 和 CXCR5 表达的表面水平也取决于 Pcyt2。总之,该研究结果表明,磷脂代谢协调了 TFH 细胞分化和体液免疫的转录后机制,突出了环境依赖性免疫信号和效应程序的代谢控制。
2021年2月25日,美国圣裘德儿童研究医院迟洪波团队在Cell 在线发表题为“In vivo CRISPR screening reveals nutrient signaling processes underpinning CD8+ T cell fate decisions”的研究论文,该研究设计了一个基于CRISPR/Cas9 的体内筛选系统,揭示了调节CD8+ T细胞命运决定的关键细胞代谢通路。
2021年2月24日,美国圣裘德儿童研究医院迟洪波团队在Nature 发表题为“Lipid signalling enforces functional specialization of Treg cells in tumours”的研究论文,该研究证明抑制依赖于Treg细胞中固醇调节元素结合蛋白(SREBPs)的脂质合成和代谢信号传导可释放有效的抗肿瘤免疫应答,而无自身免疫毒性。总之,该研究表明代谢重编程可增强Treg细胞在肿瘤中的功能专一性,从而为靶向这些细胞进行癌症治疗提供了新途径。
在数百万年的人类进化过程中,与饮食相关的营养可用性是塑造人类生理机能的环境影响的关键因素,人类进化见证了与人类生理和病理适应相关的重大饮食变化。然而,尽管对饮食与人类健康和疾病之间的联系进行了广泛的研究,但对循环饮食衍生的营养素如何影响特定的人类生理和病理过程知之甚少。主要原因是,由于食物种类繁多,而且生物体水平饮食代谢的高度复杂性,破译这种联系的机制研究是困难的。因此,研究人员通过组装血液营养化合物库来应对这一难题,并进行筛选以初步识别影响抗肿瘤免疫的膳食营养素。
综合时间基因组学和蛋白质磷酸化分析表明,细胞表面受体GPR43是TVA的靶标。GPR43(也称为游离脂肪酸受体2 (FFAR2))是一种短链脂肪酸(SCFA)结合的G蛋白偶联受体(GPCR),可被其激动剂(包括醋酸盐、丙酸盐和丁酸盐)激活,这些激动剂是肠道微生物中常驻细菌在膳食纤维发酵过程中产生的SCFA。GPR43与Gαi和Gαq均偶联。GPR43可能通过介导其SCFA激动剂(包括丙酸盐)的功能参与抗炎。虽然有报道称SCFA需要GPR41和GPR43来建立具有优化回忆反应的记忆性CD8+ T细胞,但GPR41和GPR43也被证明是SCFA促进CD8+ T细胞抗肿瘤活性并非是必需的。然而,GPR43是否在调节效应 CD8+ T 细胞功能中作为长链脂肪酸的传感器发挥作用仍然未知。
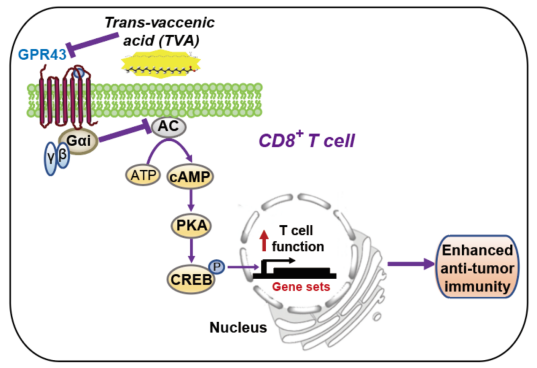
TVA调控CD8+ T细胞机制示意图(图源自Nature )
该研究发现TVA-a长链脂肪酸-减弱Gαi偶联GPR43活性并导致cAMP水平升高,从而对抗SCFAs对cAMP的整体负面影响,从而增强效应CD8+ T细胞功能。该结果揭示了人类饮食进化过程中的一种机制,与肠道微生物来源的体内SCFAs作为GPR43激动剂相比,机体外TVA通过外部调控对CD8+ T细胞进行重编程,使GPR43失活。该研究通过对膳食来源营养素的综合评价,促进了对饮食与人体生理和病理之间机制联系的识别和理解。因此,尽管食物和饮食来源有很大的多样性,但专注于单个营养素的研究可以用来确定营养对人类健康和疾病影响的分子机制,以及治疗的有效性。
芝加哥大学陈靖教授,芝加哥大学何川教授,圣裘德儿童研究医院迟洪波教授为该文共同通讯作者。芝加哥大学范皓博士,南方科技大学助理教授夏思源,芝加哥大学向俊鸿博士为论文共同第一作者。
原文链接:
https://www.nature.com/articles/s41586-023-06749-3