2023年11月18日,常熟理工学院张杰、安徽医科大学古月及浙江中医药大学药学院Yang Yanzi共同通讯在Molecular Cancer(IF=37)在线发表题为“ELF5 drives angiogenesis suppression though stabilizing WDTC1 in renal cell carcinoma”的研究论文,该研究发现ELF5通过稳定WDTC1在肾细胞癌中驱动血管生成抑制。ELF5在RCC细胞和组织中低表达。高表达ELF5显著抑制RCC细胞的增殖、迁移和侵袭能力,抑制血管生成。ELF5过表达可抑制小鼠肿瘤生长。
ELF5在RCC中高度甲基化,DNA甲基转移酶(DNA methyltransferases, DNMT )可促进ELF5在RCC细胞中的高甲基化水平。进一步证实ELF5在RCC中转录激活USP3。此外,USP3抑制WDTC1泛素化。ELF5可以促进USP3介导的WDTC1稳定。此外,WDTC1沉默逆转了ELF5过表达对RCC进展的作用。DNA超甲基化导致的ELF5下调通过RCC中的USP3/WDTC1轴抑制RCC的发展。
肾细胞癌(Renal cell carcinoma, RCC)是一种起源于肾小管的常见恶性肿瘤。其发病率仅次于前列腺癌和膀胱癌,近十年来呈上升趋势。由于缺乏特异性症状,RCC通常诊断较晚,因此治疗难度较大。转移性RCC患者比例较高,生存率较低,仅为13%左右。目前,根治性手术仍是早期RCC患者的主要治疗方法。由于RCC对放疗不敏感,基因靶向治疗为其治疗提供了一个有希望的新方向。因此,鉴定新的可行的生物标志物是开发更好的治疗方法和提高RCC患者生存率的关键。
血管生成是指原有血管生成新血管,是组织修复和发育的重要生理过程。越来越多的研究表明,血管生成是实体瘤发展的关键过程。它为肿瘤提供生长所需的氧气和营养,同时允许二氧化碳和代谢物的排泄。此外,血管生成支持恶性细胞从原发肿瘤部位转移到远处器官。血管内皮生长因子(Vascular endothelial growth factor, VEGF)由于具有促有丝分裂功能,是最有效的促血管生成因子。在RCC中,有报道称TNF受体相关因子1可通过促进血管生成来促进舒尼替尼耐药。F-Box蛋白22通过抑制细胞迁移侵袭和VEGF介导的血管生成,抑制RCC的肿瘤转移。沉默表皮生长因子样结构域蛋白7可通过抑制RCC血管生成来抑制肿瘤生长。因此,血管生成的调控对于制定新的RCC治疗策略至关重要。
ELF5属于ETS家族,可以调控人类癌症中参与细胞增殖、分化、凋亡和转移的基因。此外,ETS家族已被证实在胚胎血管生成、血管生成和造血中发挥重要作用。ELF5主要表达于上皮细胞,是癌细胞EMT的抑制因子。大多数证据表明,ELF5在抑制不同人类癌症的肿瘤发生和发展中发挥重要作用。例如,ELF5缺失可通过干扰素-γ信号传导促进乳腺癌转移。ELF5通过灭活SMAD3抑制前列腺癌上皮-间质转化过程。ELF5抑制卵巢癌细胞迁移和侵袭。重要的是,ELF5 mRNA和蛋白在RCC中已被证实降低,重新表达ELF5可抑制细胞增殖和存活,这表明ELF5在肾脏中具有抑瘤活性。然而,ELF5在RCC血管生成中的作用尚不清楚。
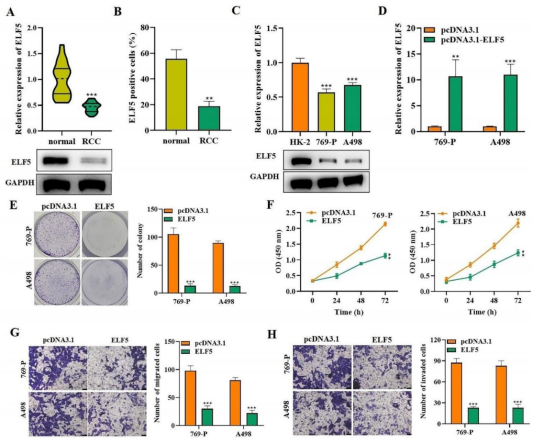
高ELF5表达抑制RCC细胞增殖、迁移和侵袭(图源自Molecular Cancer )
表观遗传改变是癌症发展的重要因素。DNA甲基化是最常见的表观遗传学形式,它可以改变基因表达而不改变DNA序列。越来越多的研究证实,基因启动子区域的高甲基化可直接导致基因表达水平的降低。DNA甲基化是由DNA甲基转移酶(DNA methyltransferases, DNMTs)建立的。5-Aza-2-脱氧胞苷(5-Aza-dC)是一种DNMTs抑制剂,可引起全基因组低甲基化并抑制癌细胞生长。
有报道称,ELF5在尿路上皮癌中的下调与DNA甲基化有关,并可通过5-Aza-dC逆转。因此,DNA甲基化也可以解释低表达的ELF5在RCC中调节肿瘤活性的作用。该研究证明ELF5在RCC中由于DNA超甲基化而下调表达。ELF5通过激活USP3的转录来稳定RCC中的WDTC1,作为肿瘤抑制因子。这些发现可能为RCC提供新的治疗靶点。
原文链接:
https://doi.org/10.1186/s12943-023-01871-2