
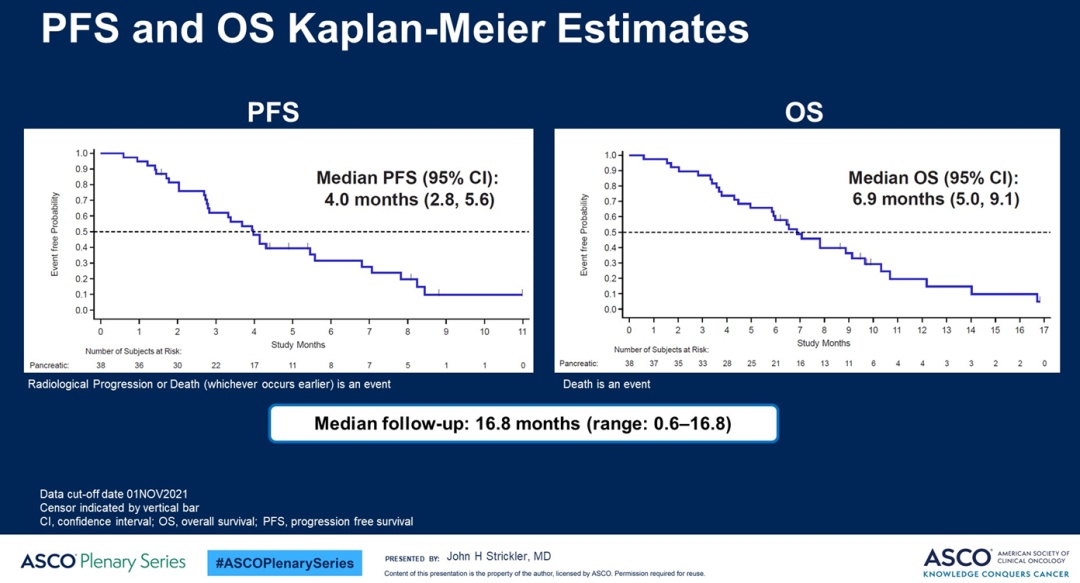
在38例接受过重度治疗的晚期胰腺癌患者中(约80%接受过二线及更后线的治疗),sotorasib治疗后经BICR评估的确证ORR为21%(8/38),疾病控制率(DCR)为84%。截至2021年11月1日,中位随访时间16.8个月时,中位PFS为4个月,中位应答持续时间(mDOR)为5.7个月,中位OS为7个月。未观察到新的不良事件,治疗相关不良事件发生率42%。最常见3级不良事件是腹泻(5%)、疲劳(5%)。

来自华盛顿大学Fred Hutchinson肿瘤研究中心的Elena Chiorean博士也对sotorasib数据进行了分析和讨论,并简单与adagrasib进行了对比。

今年1月21日,另一家开发KRAS抑制剂进度领先的明星公司Mirati Therapeutics也公布了其KRAS G12C抑制剂adagrasib(MRTX849)在II期KRYSTAL-1研究中针对胰腺癌的积极结果。
数据显示,截至2021年9月10日,在10名可评估的胰腺癌患者中,客观缓解率为50%(均为PR),包括1例未确认的部分缓解(PR),中位mDOR为7.0个月;中位随访时间为8.1个月,mPFS为6.6个月(95% CI:1.0-9.7)。
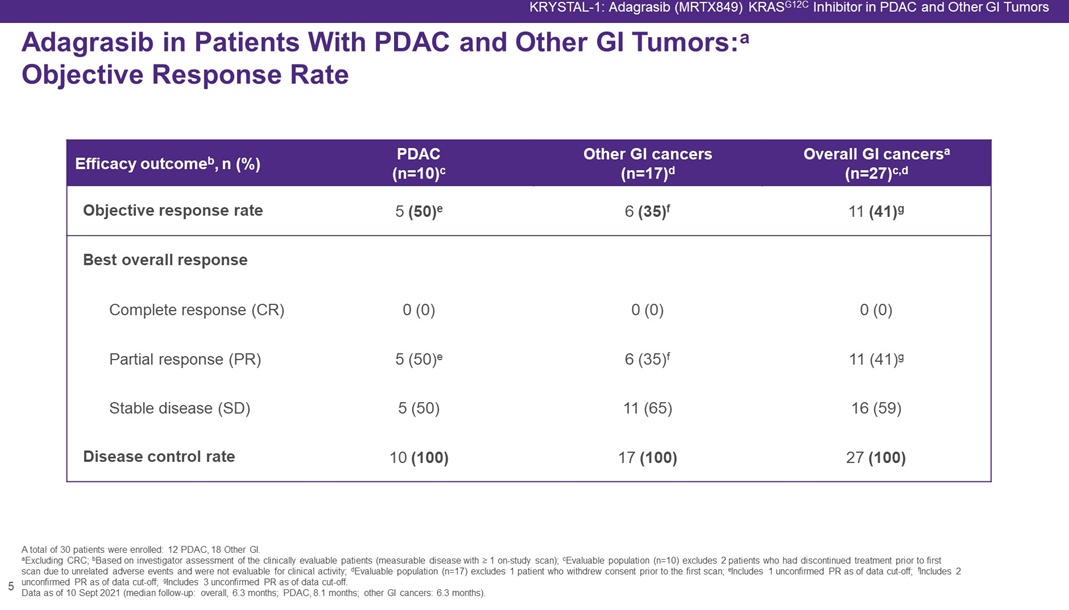
仅从当前的小样本数据上看,adagrasib对胰腺癌患者的疗效更好一些。从分子特性上看,Adagrasib(MRTX849)是一种更高选择性的小分子KRAS G12C抑制剂,通过优化后可以维持长久的靶向抑制,这一特性对于治疗每24–48小时再生一次的KRASG12C突变癌症非常重要。不过,adagrasib相对于sotorasib(QD)采用的是每天2次的给药频率。
胰腺癌是一种预后极差的恶性肿瘤,也是美国的第4大癌症死亡原因,5年生存率只有大约10%,存在巨大未满足临床需求,特别是对于一线治疗后进展的晚期胰腺癌患者,FDA当前批准的二线疗法只有16%的应答率以及6个月的生存期。对于二线治疗后进展的胰腺癌患者,FDA目前未批准任何疗法。
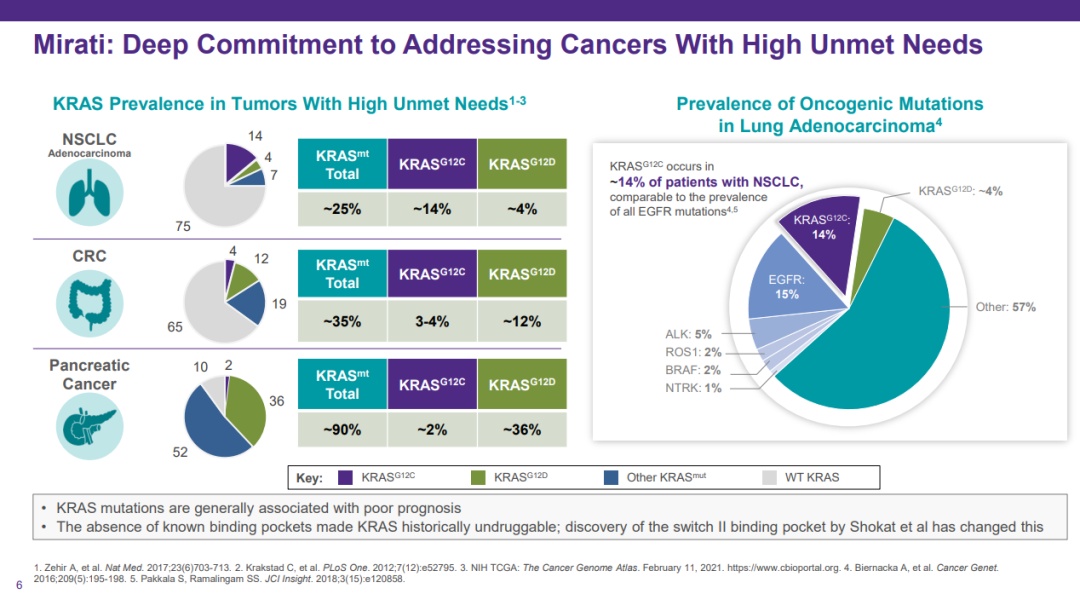
KRAS在胰腺癌中的突变远高于肺腺癌(30% vs 90%),但是KRAS G12C突变在胰腺癌中的占比较低,约为1~2%(14% vs 2%)。不过,adagrasib和sotorasib都在胰腺癌中表现出令人鼓舞的临床数据,有望成为胰腺癌KRAS G12C突变患者的后线治疗新选择。
Sotorasib是全球首个上市的KRAS G12C抑制剂,在2021年5月获批二线治疗KRAS G12C突变的晚期或转移性非小细胞肺癌(NSCLC),2021年的全球销售额是9000万美元。Adagrasib目前已向FDA递交上市申请,再鼎医药在2021年6月以3.38亿美元交易总额获得在大中华区研究、开发、生产及独家商业化adagrasib的权利。
Adagrasib和sotorasib虽然都在胰腺癌KRAS G12C突变患者中表现出令人鼓舞的临床数据,但也略有差异。整体上,两个研究的患者大多都是接受了二线及更后线的治疗,在比例上Adagrasib较高(92% vs 78.9%);不过,sotorasib患者治疗线级区间为1-8,而Adagrasib为1-4,在3线及以上患者中,两者比例差别不大(44.7% vs 50%)。
有效性数据上,Adagrasib在各方面都显示了一定优势。不过,Adagrasib的临床有效性数字只是在10例患者中评估(2例患者在首次评估之前已经中断治疗),而sotorasib则纳入了38例患者。正如Elena Chiorean博士所说,Adagrasib的ORR数据is very very encouraging,但在一个小的患者群体时,存在太多的变量,当放大到40名或100名患者我们不能假设这些数据必然会成功。
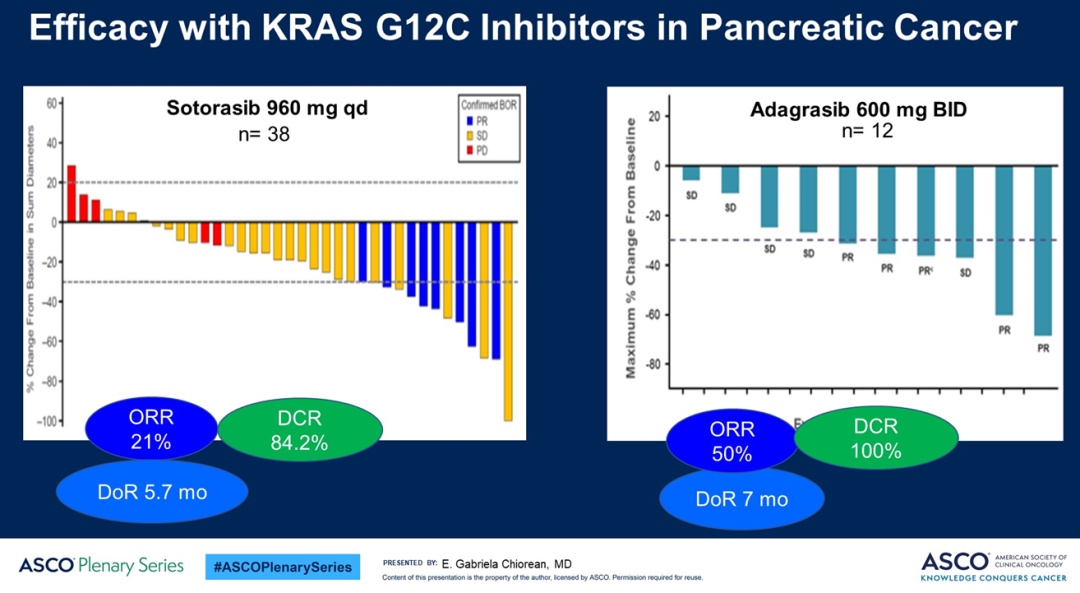
此外,在患者接受治疗的持续时间上,sotorasib似乎显示更长的趋势,但在DoR上依旧是Adagrasib占据优势。

可以看出,对于胰腺癌KRAS G12C突变患者,Adagrasib和sotorasib都显示了早期的令人鼓舞的临床数据,有望成为新的治疗选择。然而,接受Adagrasib和sotorasib治疗的患者都会较早的出现耐药,致使临床疗效不能持久,在NSCLC临床数据中同样如此。
2021年,在《新英格兰医学杂志》发表过一篇KRAS G12C获得性耐药机制的研究数据,数据包含了临床患者和细胞扫描的数据,也测试了哪些双重突变基因使细胞能够对sotorasib或adagrasib 样化合物产生耐药性。

对于adagrasib和sotorasib在胰腺癌中的耐药机制是否存在差异,John H Strickler博士并未对sotorasib这部分数据给出直接回答,但表示在患者中采集了血样检测,期望能够在未来公布这一部分数据。Elena Chiorean博士则认为,鉴于此前KRAS G12C抑制剂在结肠癌和肺癌中表现出的相似耐药机制,认为在胰腺癌中可能也会具有相似性。
在治疗过程中,对患者进行连续检测,以及思考如何预防耐药性,能够实现更有效的胰腺癌治疗。目前而言,药物联合治疗是一种潜在的对抗耐药机制的策略。

Sotorasib也在开展多项联合治疗的临床研究,包括在胰腺癌中。胰腺肿瘤细胞可以促进周围基质细胞和免疫抑制细胞的激活,包括调节性T细胞(Tregs)、骨髓来源的抑制性细胞(MDSCs)、肿瘤相关性巨噬细胞(TAMs),并通过分泌一系列细胞因子和趋化因子使这些细胞聚集到肿瘤部位。另一方面,被激活的基质细胞生成大量细胞外基质,在胰腺肿瘤细胞周围形成纤维“屏障”,阻止效应细胞(T细胞和NK细胞)渗透至肿瘤,使肿瘤细胞逃避免疫监视。所以,在胰腺癌中,通常表现免疫抑制环境,致使肿瘤免疫治疗几乎全军覆没。