近日,《Cancer Discovery》发表了一项大型前瞻性、非干预性、观察性I-III期肺癌术后ctDNA-MRD研究结果,结果显示:纵向ctDNA-MRD检测为阴性的患者可以定义为潜在的治愈患者,并且无法从辅助治疗中受益。ctDNA-MRD转阳或复发的高峰期在术后第12-18个月左右,提示临床应至少密切观察18个月。如果ctDNA-MRD持续阴性至第18个月后,其复发风险逐渐降低。1
该研究共纳入261例I-III期(肿瘤直径≥2cm)NSCLC患者,经过根治性手术切除后进行术后动态血液ctDNA-MRD检测,其中术前血液样本261例,术中肿瘤组织256例,术后血液样本652例。在这项研究中,系统地回答了以下四个问题:1)Nonshedding tumor(非脱落肿瘤)问题;2)ctDNA-MRD PPV及NPV问题;3)ctDNA-MRD灵敏度问题;4)ctDNA-MRD指导辅助治疗问题。
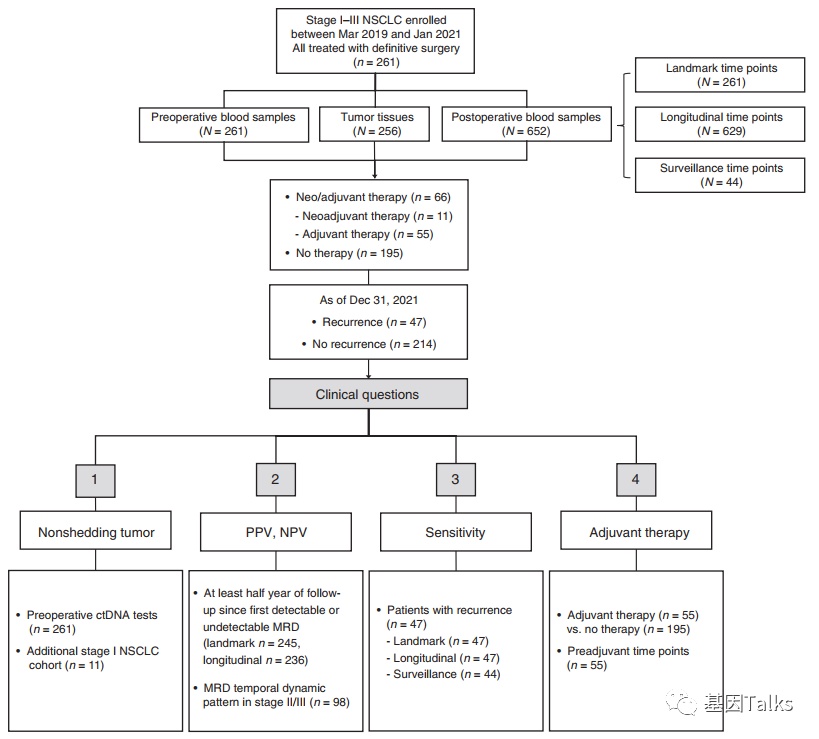
▲ 患者纳入亚分析流程图,系统回答了临床上四个问题
技术层面分析
ctDNA-MRD检测策略:(非完全)Tumor-agnostic assays策略,固定panel;
检测panel:使用类似CAPP-seq panel的设计概念,开发了一款固定化338基因MRD panel,大小为0.55Mb,专门用于肺癌、结直肠癌和肝细胞癌(设计原则是三种癌症类型中最常见的驱动基因 + 免疫治疗相关敏感/耐药基因 + Geneplus近5万相关癌症数据库及COSMIC和TCGA数据库中的热点突变区域);基线肿瘤组织检测为1,021基因大panel,大小为1.5Mb;
检测样本:肿瘤组织样本(新鲜冷冻组织/FFPET),血浆cfDNA样本(20ml全血);
样本input量:gDNA为400~800ng;cfDNA为52ng(中位值);
建库方法:探针杂交捕获法(IDT),其中cfDNA建库添加UID接头;
测序平台:DNBSEQ-T7RS测序仪(MGI)或Gene+Seq-2000测序系统(吉因加)
测序深度:肿瘤组织样本平均测序深度为1,214X,检出中位突变数为6个(1-93);血浆cfDNA样本平均测序深度为30,000X;
cfDNA LoD:变异等位基因频率(VAF)的LoD为 0.1%;
ctDNA-MRD分析:检测到至少一种变异的血浆样本被定义为ctDNA-MRD阳性。其calling有两种方式,一种是Tumor-informed calling,一种是Tumor-naïve calling。其中肿瘤组织衍生的变异,在血浆ctDNA中判断的话,驱动基因需要≥2条reads,乘客基因需要≥4条reads,如果非肿瘤组织衍生的变异,判断标准会高一倍,驱动基因需要≥4条reads,乘客基因仅需要≥8条reads;
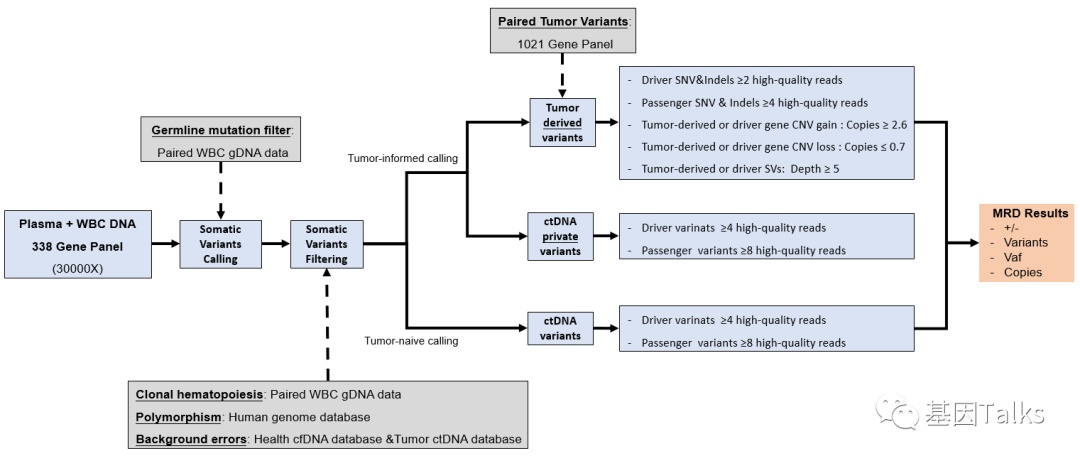
▲ ctDNA-MRD检测框架
ctDNA-MRD检测样本采集情况: 研究者在术前和术后预先设定的时间点,分别使用两支10ml的streck管采集外周血20ml。手术前3天采集术前血液样本。未接受辅助治疗的患者以术后1个月(±7天)为landmark(界标)时间点。对于接受辅助化疗的患者,辅助治疗前时间点定义为手术后及辅助治疗前至少1周,landmark时间点为最后一个化疗周期后1个月(±7天)。对于长期接受EGFR抑制剂或ICIs辅助治疗的患者,landmark时间点为手术后及辅助治疗前1个月(±14天)。Longitudinal(纵向)时间点为landmark检测后每3~6个月一次。Surveillance(监测)时间点为临床复发前6个月内的检测。由于前瞻性的影像学随访和采血在同一时期,监测时间点可能与临床复发在同一天。
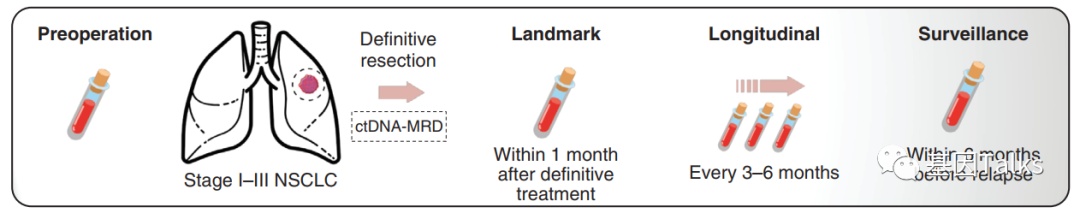
▲ ctDNA-MRD研究流程
*Landmark:界标时间,即术后/辅助治疗后1个月内的单点检测
Longitudinal:纵向时间,即Landmark检测后每隔3-6月进行一次检测
Surveillance:监测时间,即临床复发前6个月内进行的检测
该研究的主要发现有:
1)Nonshedding tumor(非脱落肿瘤)问题:
考虑到肿瘤的存在,术前ctDNA检测可用于评估每个个体的肿瘤DNA脱落情况。所有入组患者(261例)术前均成功进行ctDNA检测,然而只有36.4%(95例)是阳性的(中位VAF为0.71%),这么低的阳性比例可能与肿瘤自身脱落DNA有关,也可能与检测方法灵敏度不够有关。
为了进一步阐明ctDNA的检测性能和肿瘤的非脱落性问题,研究者进一步对11例 I 期患者,术前2轮外周血ctDNA检测,术中通过肺叶标本切除下来后收集肺叶静脉残端血检测ctDNA,两种ctDNA检测显示100%一致。其中6例患者肺叶静脉残端血和外周血ctDNA检测均为阴性,证实了确实存在肿瘤本身不释放ctDNA的Nonshedding肿瘤的存在。另外,5例肺叶静脉残端血ctDNA阳性,其中3例外周血ctDNA只有1轮阳性,这也提示目前的技术手段对低频突变(特别是VAF<0.05%)的检测灵敏度是不足的。
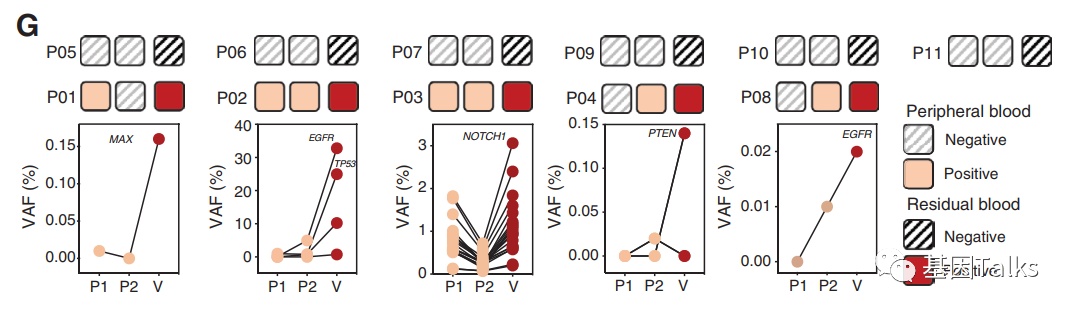
▲ 11例I期NSCLC患者:2轮外周血ctDNA vs 肺叶残血ctDNA
更为重要的是,术前血液中检测不到ctDNA似乎并不影响其监测疾病复发的有效性。41例复发性ctDNA-MRD阳性患者中,14例(34.1%)术前ctDNA检测为阴性。相反,所有ctDNA-MRD未检测到的复发患者术前ctDNA检测均呈阳性(6/6,100%)。

▲ 通过复发患者反推术前ctDNA与术后MRD检测及复发关系
2)ctDNA-MRD PPV及NPV问题:
术后单点(landmark)ctDNA-MRD的PPV达81.0%,NPV达86.6%,纵向分析可进一步提高准确度,纵向(Longitudinal)ctDNA-MRD的PPV可达89.1%,NPV可达96.8%,意味着术后ctDNA-MRD持续阴性,其复发的可能仅为3.2%。纵向ctDNA-MRD检测为阴性的患者可以定义为潜在的治愈患者(与术后单点检测相比,纵向分析曲线近乎完美)。
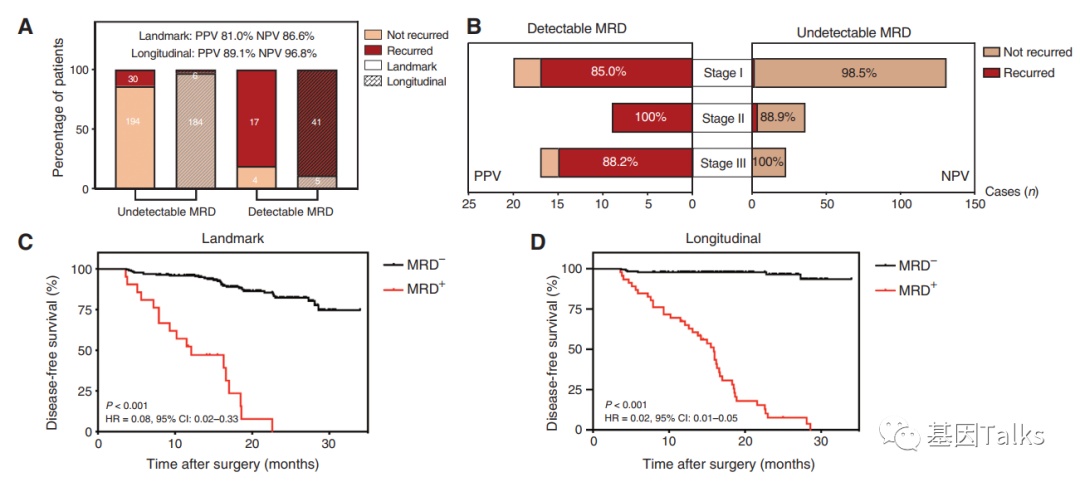
▲ 术后ctDNA-MRD动态分析
此外,对II-III期肺癌患者术后的ctDNA-MRD动态分析发现,ctDNA-MRD转阳或复发的高峰期在术后第12-18个月左右,提示临床应至少密切观察18个月。如果ctDNA-MRD持续阴性至第18个月后,其复发风险逐渐降低,可定义为潜在治愈人群。
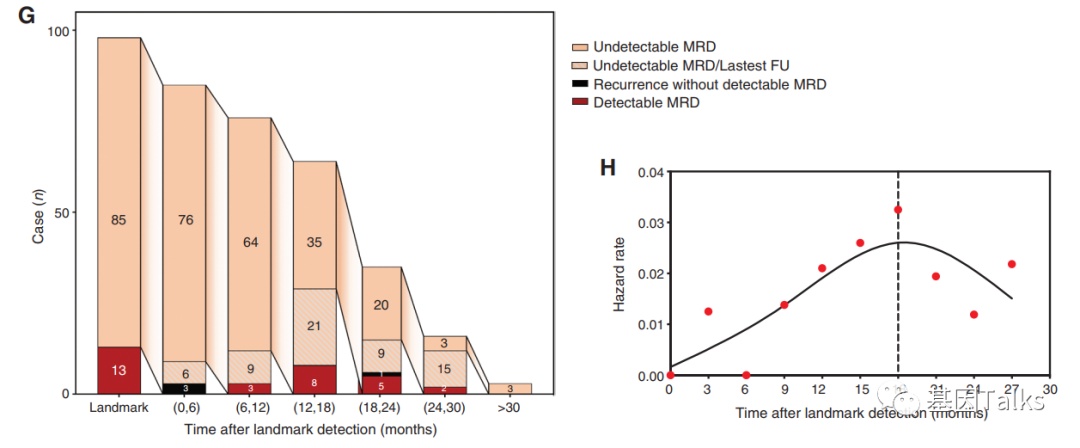
▲ ctDNA-MRD转阳或复发的高峰期在术后第18个月左右
3)ctDNA-MRD灵敏度问题:
术后单点(landmark)的ctDNA-MRD灵敏度为36.2%,纵向(Longitudinal)时间点的ctDNA-MRD灵敏度可提高到87.2%。这也提示:就目前而言,单次术后ctDNA-MRD检测的灵敏度是小于50%的,持续的纵向ctDNA-MRD检测可大幅提高其灵敏度。
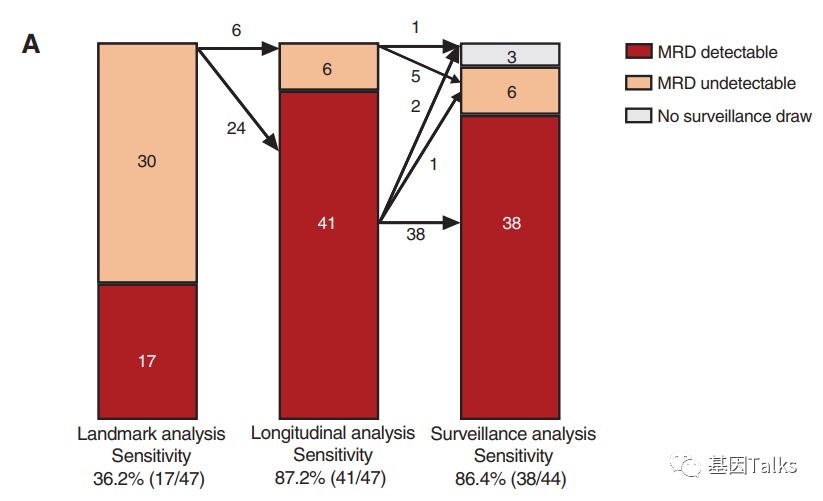
▲ ctDNA-MRD检测灵敏度分析
4)ctDNA-MRD指导辅助治疗问题:
术后ctDNA-MRD检测阴性患者的肿瘤负荷极低,辅助治疗可能对这些患者是不必要的。术后辅助治疗前ctDNA-MRD检测阳性的患者,辅助治疗可以改善其DFS,但是对于ctDNA-MRD检测阴性的人群,辅助治疗无获益。识别和避免对潜在治愈人群的过度治疗是一个重要的临床问题。
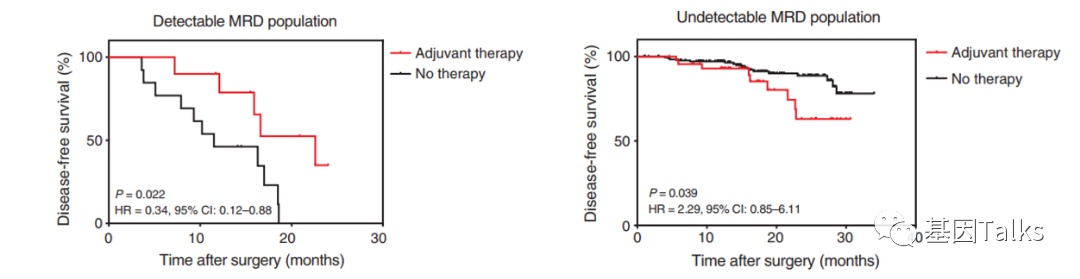
▲ ctDNA-MRD检测与辅助治疗
另外,该研究也存在一定的局限性。1)随访时间较短(中位随访时间为19.7个月)。在该项研究中,只有47例复发。2)landmark检测后没有严格按照每3-6个月进行ctDNA-MRD随访。然而,该研究证实了ctDNA-MRD的预后价值具有足够的统计学意义。
总体而言,在这项前瞻性研究中,研究团队证实了基于ctDNA的MRD评估对NSCLC根治术后患者的预后价值。同时,研究团队还强调了ctDNA-MRD纵向分析的临床应用价值:ctDNA-MRD阴性可以用于确定局部NSCLC的潜在治愈患者。此外,亚组分析提示,ctDNA-MRD阴性的患者可能不需要辅助治疗。最后,研究团队指出,脑复(转)发(移)仍然是NSCLC ctDNA-MRD监测的一个主要挑战,未来是否会考虑CSF-MRD进行监测?
参考资料:
1.Jia-Tao Zhang, Si-Yang Liu, Wei Gao, Si-Yang Maggie Liu, Hong-Hong Yan, Liyan Ji, Yu Chen, Yuhua Gong, Hong-Lian Lu, Jun-Tao Lin, Kai Yin, Ben-Yuan Jiang, Qiang Nie, Ri-Qiang Liao, Song Dong, Yanfang Guan, Pingping Dai, Xu-Chao Zhang, Jin-Ji Yang, Hai-Yan Tu, Xuefeng Xia, Xin Yi, Qing Zhou, Wen-Zhao Zhong, Xue-Ning Yang, Yi-Long Wu; Longitudinal Undetectable Molecular Residual Disease Defines Potentially Cured Population in Localized Non–Small Cell Lung Cancer. Cancer Discov 2022.