
▲ MRD示意图
综合可见,微小残留病灶(MRD)是血液肿瘤和实体肿瘤患者可能短期或长期复发的已知指标。最近的研究集中在如何利用可靠的方法来检测非血液系统肿瘤(或实体肿瘤)的MRD,比如液体活检。
近日,发表在《cancers》杂志上的一篇综述讨论了通过液体活检在实体肿瘤中检测MRD的不同方法,它们各自的潜力和问题,以及MRD检测对癌症患者管理的临床影响。4

该篇综述主要关注ctDNA(循环肿瘤 DNA),这是基于肿瘤特异性基因组改变的MRD的常用检测方法,并且在日常临床实践中已通过NGS方法或PCR方法得以实施。
作者指出,目前的ctDNA-MRD检测方法可分为个性化方法(Personalized Methods)和非个性化方法(Non-Personalized Methods)两种,其中个性化方法又可以分为基于肿瘤定制化panel(Tumor-Customized Based Panels)和基于定制化PCR检测(Custom-Based PCR Assay)。
ctDNA-MRD个性化方法
ctDNA-MRD个性化方法是基于肿瘤基因组先验或知情的方法,可分为基于肿瘤定制化panel和基于定制化PCR检测两种。
1)基于肿瘤定制化panel:
利用基于个体患者肿瘤定制的基因panel是目前检测ctDNA-MRD最有效的方法之一。一旦对进行(手术/穿刺)活检的肿瘤组织样本使用全外显子组测序(WES)进行测序,就可以创建一个自定义 NGS panel 来突显出后续样本检测中感兴趣的目标区域。每次使用具有特定目标的定制panel而不是WES可以提高检测的灵敏度和测序深度,这意味着即使存在微量的ctDNA变异也可以被检测发现。
这种ctDNA-MRD检测策略已在多项临床研究中得以实施,但选择哪些肿瘤变体构成肿瘤个性化panel可能是主观或随意的,通常基于疾病相关的生物信息学算法,并且可以在选择乘客突变时忽略驱动突变。ctDNA-MRD阳性阈值也是一个主观决定,一些研究者将cut-off值设置为每个样本1个突变,5 而有些研究者则要求每个样本至少检测到2个突变。6
此外,这种技术需要先获得肿瘤组织样本,这本身就会产生几个问题。首先,根据位置(例如靠近血管),获得高质量的活检可能具有挑战性,有时会给患者带来风险(出血和疼痛)。其次,由于肿瘤异质性,基于特定肿瘤组织样本序列的患者特异性组合无法捕获同一肿瘤其他部位以及远处转移部位的基因组变化。第三,原发肿瘤及其转移的基因组景观会随着治疗和疾病的自然过程选择特定的肿瘤克隆而随时间变化。因此,基于肿瘤定制化panel可能会存在丢失血浆(可能提供信息)改变的风险,使初始定制化panel不太准确。这些都有进步的空间。
最后,作者表明,基于肿瘤定制化panel即使存在这些缺点,但这种方法已成为目前检测ctDNA-MRD的金标准。因为它能够检测非常微量的ctDNA。
2)基于定制化PCR检测
液滴数字PCR(ddPCR)是一种高度特异性的技术,它允许检测单个预定义的基因组变异,并且在ctDNA含量非常低的情况下(低至0.01%的VAF)。ddPCR具有提供定量结果的优势,并且与qPCR不同,它可以呈现一定比例的变异等位基因频率。
ddPCR旨在检测已在肿瘤组织中发现的基因组变异,因此,这种ctDNA-MRD检测方法与上述基于肿瘤定制化的NGS panel方法优缺点一致。具体而言,基于ddPCR检测ctDNA-MRD在血液肿瘤中得到证实,然而它在实体瘤中的灵敏度尚未确定(数据比较少),不过在热点突变已被确定为驱动突变的肿瘤中显示出有希望的前景。
综合而言,定制化NGS panel通常是全面的或特定于单一肿瘤类型,而定制化PCR通常用于识别高特异性突变的肿瘤类型。
ctDNA-MRD非个性化方法
泛癌种和癌症特异性NGS panel已经被开发出来,但一般来说,这些固定panel在准确性方面遵循相同的一般规则,即panel size越大,检测率越低。准确性也因癌症类型而异,固定panel的阴性预测值(NPV)也会波动,特别是在治疗后。
为了提高ctDNA-MRD非个性化方法在特定人群中的检测灵敏度,一些研究小组设计了更小的固定基因panel,限制靶基因的大小,以便将数据容量转移到最大限度的测序深度。
从临床医生的角度来看,ctDNA-MRD检测的主要目的是能够根据患者的特定癌症适当地升级或降级治疗。ctDNA-MRD研究显示出可喜的结果,但挑战依然存在。除上述技术问题外,目前在日常临床实践中还没有标准化的实施方法。
虽然ctDNA-MRD个性化方法使用较敏感的技术并可以准确检测肿瘤变异,但对肿瘤组织进行测序,然后设计针对患者的NGS或PCR检测产品,既昂贵又耗时。因此,从理论上讲,ctDNA-MRD非个性化的方法在临床实践中更实用,因为一种技术可以为患有同一种肿瘤类型的多个患者提供服务,甚至可能用于不同类型的肿瘤。然而,直到最近,该方法即使使用了条形码技术,灵敏度还是不够,不能准确识别MRD的风险可能会对患者的预后产生负面的影响。所以,基于肿瘤定制化或个性化的方法仍是目前检测ctDNA-MRD的金标准。
此外,想要准确且靠谱的检测ctDNA-MRD,治疗后取样的时间也很重要。因为ctDNA的半衰期约为30分钟~2小时,由肿瘤细胞和细胞死亡分泌。因此,治疗后ctDNA减少没有准确的清除时间。至少在目前,在治愈性治疗后1-2周内评估ctDNA-MRD可能是有问题的,并且在获得结果之前延迟辅助治疗可能会降低患者的预后。
临床上操作时,考虑到辅助治疗的紧迫性,可以选择尽早抽取血液样本,例如在手术后第2周,然后在手术后5周再次抽取血液样本。如果可以在早期血样中检测到ctDNA-MRD阳性,则可以更快地启动辅助治疗。如果没有,后面的血液样本可以为ctDNA-MRD阴性患者的再次检测提供更好的机会,因为此时的ctDNA-VAF会更高。
▲ 手术创伤对ctDNA-MRD检测的影响
正在进行的基于ctDNA作为MRD标志物的临床试验主要集中在四个方面:预后(A),强化(B),降级(C)和综合(D)治疗,如果想设计ctDNA-MRD的临床试验,可以参考这四种研究策略进行设计。
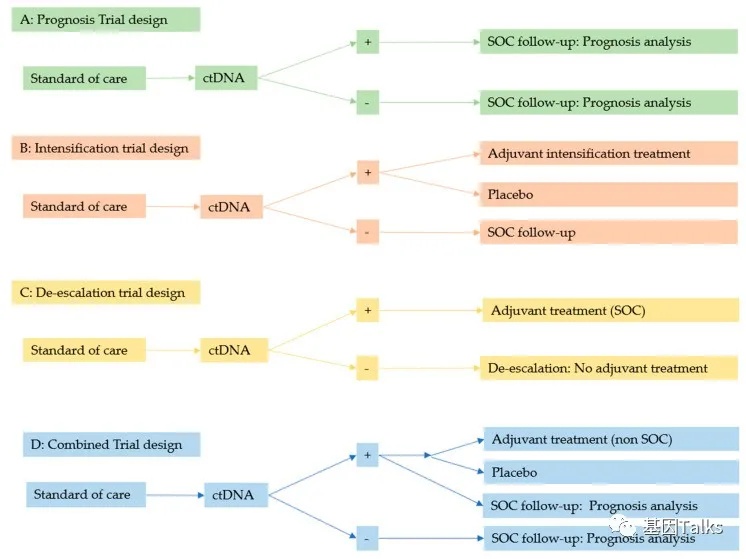
▲ ctDNA-MRD临床试验设计
通过ctDNA检测MRD是液体活检的重要潜在应用,可帮助个体肿瘤患者的辅助治疗。然而,在这些评估能够在临床实践中实施之前,有几个技术问题需要解决。我们需要精心设计随机介入的临床试验,以评估在ctDNA-MRD阳性患者中,治疗升级是否能改善癌症预后,以及在ctDNA-MRD阴性患者中,治疗降级是否安全。这些前瞻性试验将确定液体活检在临床指南中的地位。对于某些肿瘤来说,ctDNA-MRD在未来几年无疑会成为日常实践中的常规生物标志物。
参考资料:
1.NIH Minimal Residual Disease Definition. [(accessed on 20 March 2021)]
2.Szczepariski T., Orfão A., van der Valden V.H., Miguel J.F.S., van Dongen J.J. Minimal residual disease in leukaemia patients. Lancet Oncol. 2001;2:409–417.
3.Wan J.C.M., Massie C., Garcia-Corbacho J., Mouliere F., Brenton J.D., Caldas C., Pacey S.C., Baird R., Rosenfeld N. Liquid biopsies come of age: Towards implementation of circulating tumour DNA. Nat. Rev. Cancer. 2017;17:223–238.
4.Honoré N, Galot R, van Marcke C, Limaye N, Machiels JP. Liquid Biopsy to Detect Minimal Residual Disease: Methodology and Impact. Cancers (Basel). 2021;13(21):5364. Published 2021 Oct 26.
5.Garcia-Murillas I.S.G., Weigelt B., Ng C., Hrebien S., Cutts R.J., Cheang M., Osin P., Nerurkar A., Kozarewa I., Garrido J.A., et al. Mutation tracking in circulating tumor DNA predicts relapse in early breast cancer. Sci. Transl. Med. 2015;7:302ra133.
6. Magbanua M., Swigart L., Wu H.-T., Hirst G., Yau C., Wolf D., Tin A., Salari R., Shchegrova S., Pawar H., et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival. Ann. Oncol. 2020;32:229–239.