一、HFD抑制肿瘤转移,提高存活率
该研究通过腹膜内注射结直肠癌(CRC)细胞系MC-38或CT-26建立腹膜转移小鼠模型。实验组与对照组分别使用脂肪含量10%的低脂食物与脂肪含量60%的HFD喂养小鼠。肿瘤接种后第14天和第21天,HFD的摄入明显抑制了附睾脂肪(eFats)、肠系膜、大网膜和肾周脂肪的肿瘤形成。此外,在不改变食物摄入量的情况下,应用HFD明显增加了小鼠的体重,且HFD的治疗显著改善了腹膜转移小鼠的存活率。
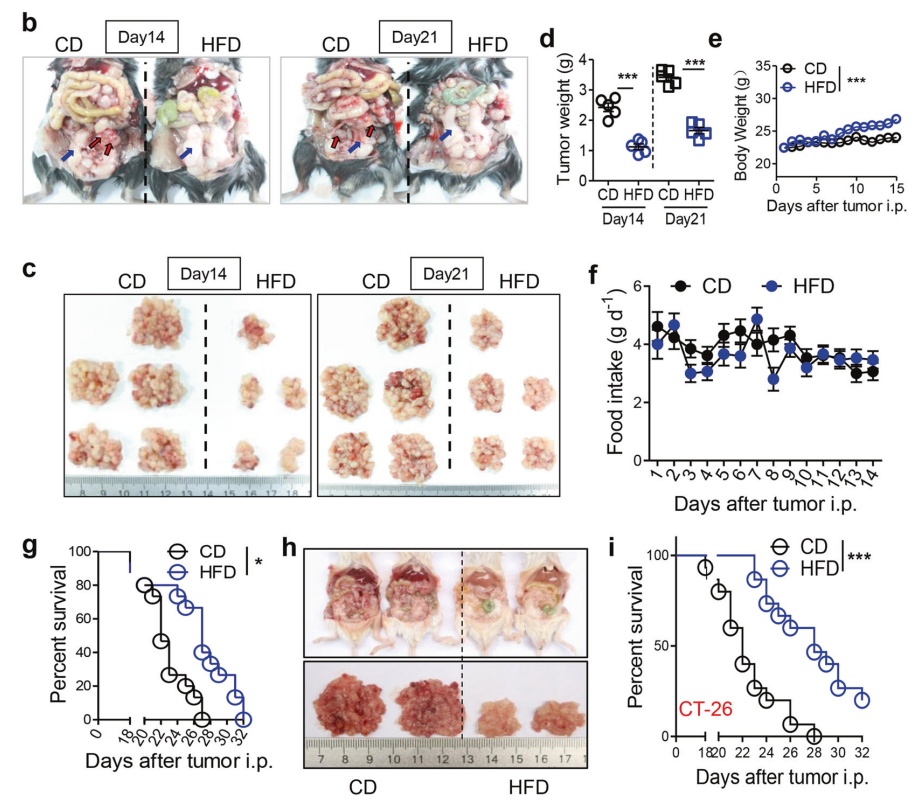
肿瘤接种后第14天和第21天,与对照组相比,HFD组明显抑制了eFats的肿瘤形成。在不改变食物摄入量的情况下,应用HFD明显增加了小鼠的体重,且HFD的治疗显著改善了腹膜转移小鼠的存活率。
在静脉转移模型中,摄入HFD可抑制MC-38细胞的肺转移。然而,在皮下接种肿瘤模型中,HFD的应用不影响MC-38细胞的生长,并且发现使用HFD进行早期7天治疗能够改善腹膜转移小鼠的存活率。
二、 HFD抗癌机制:增强巨噬细胞抗肿瘤作用
1
促进M2型巨噬细胞向M1型转化
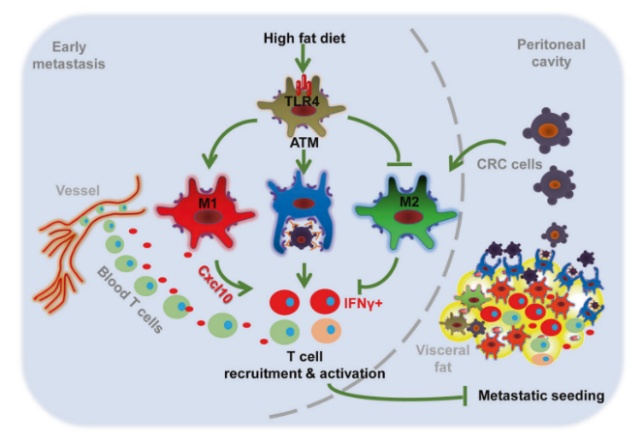
脂肪组织被多种免疫细胞浸润,其中巨噬细胞在调节局部和全身炎症以及免疫状态中起着核心作用。肿瘤微环境中,M1巨噬细胞通过吞噬作用或介导Th1反应有效杀死肿瘤细胞,而M2巨噬细胞通过诱导免疫抑制和Th2反应来促进肿瘤发展,因此,从M2表型转化为M1表型对癌症的有效治疗至关重要。目前已有研究表明,摄入含有高水平饱和脂肪酸的高脂饮食(HFD)可以将脂肪组织巨噬细胞(ATM)从M2类表型(CD11c-CD206+)转化为M1类表型(CD11c+CD206-)。
2
增强M1型巨噬细胞作用
HFD调节CRC肿瘤微环境,刺激M1巨噬细胞的活化和吞噬作用,进一步促进内脏脂肪中CD4+和CD8+T细胞的募集和激活,从而防止结直肠癌的播散。
HFD促进T细胞从血液迁移到内脏脂肪。该研究发现在缺乏淋巴细胞的裸鼠中,与对照组相比,HFD对CRC细胞的腹膜播散失去了抑制作用。这表明,此抑制作用依赖于淋巴细胞。此外,还发现HFD明显增加了肿瘤播散的eFats中总T细胞、CD4+和CD8+T细胞的比例,而血液中T细胞比例下降。
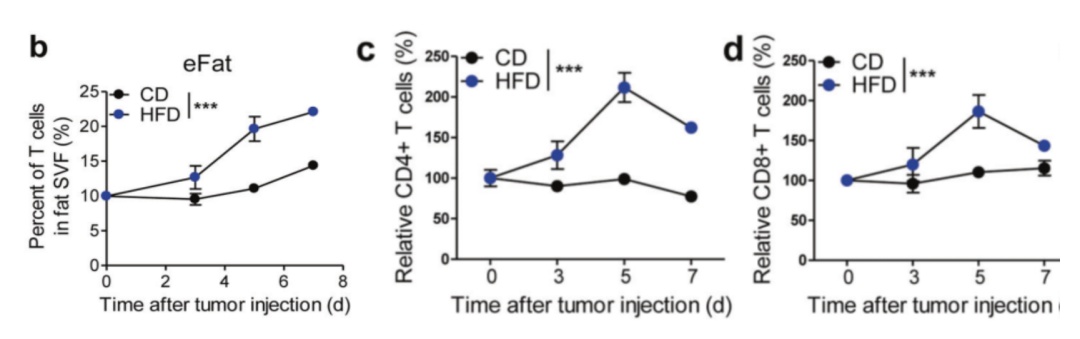
HFD明显增加了肿瘤播散的eFats中总T细胞、CD4+和CD8+T细胞的比例
HFD诱导巨噬细胞来源趋化因子CXCL10表达促进T细胞转移。研究通过RNA测序分析筛选了一系列与HFD相关的趋化因子,发现与T细胞浸润和功能有关的是趋化因子CXCL10、CXCL16、CCL8、和CCL2,而 HFD对CXCL10的诱导最为明显。
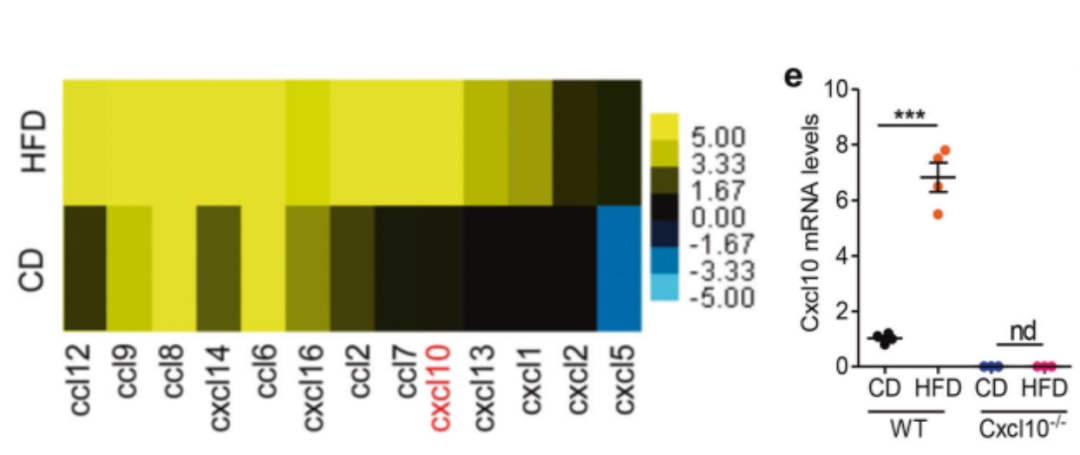
通过RNA测序分析筛选了一系列与HFD相关的趋化因子,在与T细胞浸润和功能有关的趋化因子中,HFD对CXCL10的诱导最为明显
热图显示了CD组与HFD组eFat中差异表达的趋化因子。CD:chow diet(对照组食物);HFD:high fat diet(实验组高脂食物);Cxcl10:C-X-C趋化因子配体10;Relative Cxcl10 mRNA levels: Cxcl10 mRNA相对水平;WT:野生型小鼠;Cxcl10-/-: Cxcl10缺陷小鼠。
HFD诱导 Toll 样受体4(TLR4)表达,促进M1类巨噬细胞聚集。根据RNA测序和KEGG富集分析,HFD治疗组eFats中的TLR和吞噬体相关的信号传导通路呈现高度富集的状态。差异基因表达分析表明,HFD治疗可显著诱导TLR4的表达。随后研究证明HFD的治疗可增加肿瘤播种的eFats中TLR4依赖性的M1类巨噬细胞的比例,并减少M2样巨噬细胞的积累,巨噬细胞的总数不发生改变。以上表明HFD调节巨噬细胞激活、T细胞募集和激活以及肿瘤转移播散依赖于TLR4。
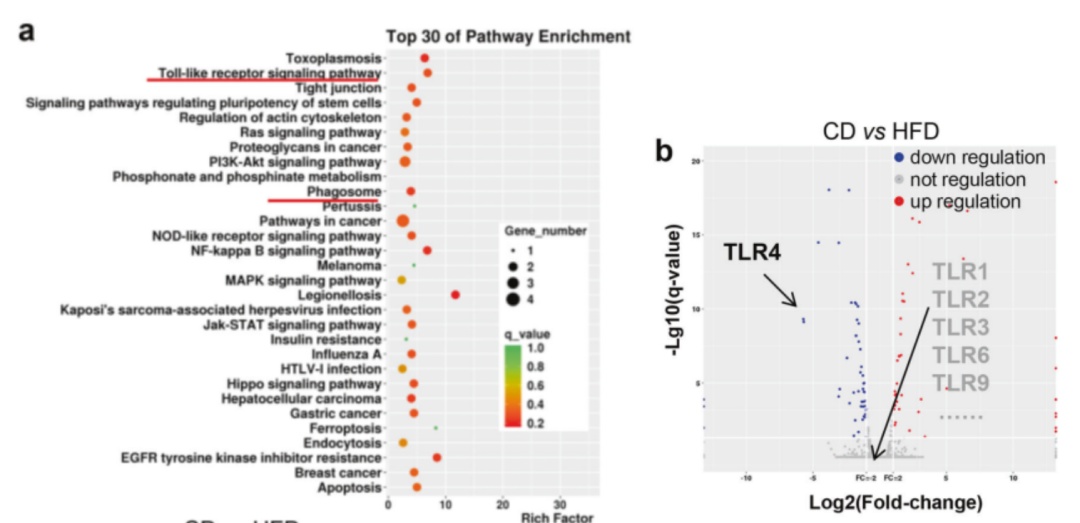
(a)HFD组eFats中的TLR和吞噬体相关的信号传导通路呈现高度富集的状态;(b)HFD治疗可显著诱导TLR4的表达。Toll-like receptor signaling pathway:Toll样受体信号通路;Phagosome:吞噬体;Rich factor:富集因子;Top 30 of Pathway Enrichment: 前30个富集信号;CD:chow diet(对照组食物);HFD:high fat diet(实验组高脂食物);down regulation:下调;not regulation:不变;up regulation:上调
三、HFD联合化疗协同抑制CRC转移,提高生存率
该研究表明HFD联合化疗药物奥沙利铂(OXP)可以提高肿瘤小鼠生存率。值得注意的是,HFD早期治疗仅7天就达到了与长期治疗相似的效果,这表明HFD治疗的及时性至关重要,作者表示最佳的HFD治疗时间是在手术后立即进行,因为大量的癌细胞可能会在此时间内释放并迅速扩散。此外,HFD与化疗药合用可协同抑制肿瘤转移。该研究表明HFD与5FU对转移性播散的治疗具有协同作用。
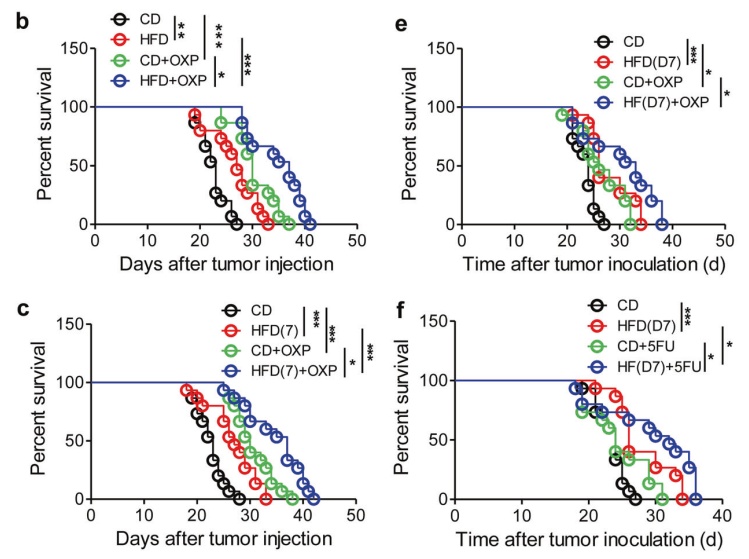
HFD和化疗药物(奥沙立铂和5-氟尿嘧啶)在抑制CRC细胞的腹膜播种方面具有协同作用,其联合治疗可显著提高接种肿瘤小鼠的存活率
Percent survival:生存百分比,Days after tumor injection:注射肿瘤后的天数,Time after tumor injection:注射肿瘤后的时间;CD组:一直使用CD(对照组食物)治疗;HFD组:一直使用HFD(高脂食物)治疗;HFD(7)组:仅从注射肿瘤后第1天到第7天使用HFD治疗;CD+OXP组:一直使用CD治疗,同时在肿瘤注射后的第1、5、9天,用奥沙利铂OXP(5.0 mg/kg)进行治疗;HFD+OXP组:一直用HFD治疗,同时在注射肿瘤后的第1、5、9天,使用奥沙利铂OXP(5.0 mg/kg)治疗;HFD(7)+ OXP组:从第1天到第7天用HFD治疗小鼠,同时在肿瘤注射后第1、5和9天用奥沙利铂(5.0 mg/kg)治疗。
小 结
沃伯格效应的存在对肿瘤细胞的生长至关重要,高有氧糖酵解的肿瘤微环境为肿瘤的免疫逃逸、进展起到了重要作用。高脂配方可通过兰德尔效应减少嗜糖效应,为肿瘤患者正常细胞提供能量底物。这篇最新研究表明,HFD能抑制CRC的转移,提高生存率,且与化疗药有协同作用。这提示我们,临床上肿瘤患者应使用高脂配方营养治疗进而获益。

参考文献:
[1] Warburg O, Wind F, Negelein E. J Gen Physiol. 1927 Mar 7;8(6):519-30.
[2] De Oliveira MP, Liesa M. The Role of Mitochondrial Fat Oxidation in Cancer Cell Proliferation and Survival. Cells. 2020 Dec 4;9(12):2600.
[3] Wei Xiang, Hongming Miao. Dietary fats suppress the peritoneal seeding of colorectal cancer cells through the TLR4/Cxcl10 axis in adipose tissue macrophages.Signal Transduction and Targeted Therapy. 2020 5:239.