
由澳大利亚儿童癌症研究所的科学家领导并发表在《自然-通讯》上的新研究发现,一种名为ALYREF的细胞蛋白在加速神经母细胞瘤中癌症驱动基因MYCN的作用方面起着至关重要的作用。这一发现对其他一些儿童的侵袭性癌症,包括某些脑瘤,以及一些成人癌症,包括卵巢癌和前列腺癌也可能有重要意义。

三分之一神经母细胞瘤患儿的癌细胞中MYCN含量非常高,他们的预后也较差。MYCN是一种短寿命转录因子,受到泛素-蛋白酶体系统的严格控制。25%的神经母细胞瘤患者会出现来自2p24的MYCN癌基因扩增,它是肿瘤侵袭性一种公认的标记物。17q21-ter扩增是神经母细胞瘤中最常见的遗传变异,发病率为38 - 65%。然而,MYCN和17q21-ter之间的机制关系仍不清楚。由于目前没有针对具有这些特征的高危神经母细胞瘤患者的特异性抑制剂,因此迫切需要确定新的靶向分子弱点。
ALYREF基因位于染色体17q25.3,是一种广泛表达的核伴侣蛋白的编码,该蛋白控制许多生物过程。ALYREF在几种人类癌症中表达失调。抑制ALYREF的表达可导致口腔鳞癌细胞增殖能力下降和迁移能力下降。尽管有大量的研究,但目前尚不清楚ALYREF的表达是如何增加的,以及ALYREF水平的升高是如何促进肿瘤发生的。
在这项新研究中,儿童癌症研究所的科学家已据Zsuzsi Nagy博士和主要研究人员Glenn Marshall AM教授和Belamy Cheung博士表示,“这是世界上第一次发现。我们已经能够首次表明,ALYREF与神经母细胞瘤细胞中的MYCN功能结合并实际控制,这意味着我们现在有了一个新的分子,一个新的方法来获得MYCN并阻止它推动侵略性的癌症生长。”
这项研究的主要结果:
在神经母细胞瘤中,ALYREF的高表达与17q21-ter的增加、mycn扩增和患者预后不良相关
研究数据表明, ALYREF的高表达强烈预测了患者的不良预后,MYCN和ALYREF可能作为神经母细胞瘤的致瘤因子共同作用。我们看到ALYREF与MYCN表达水平以及ALYREF拷贝数之间存在显著的正相关关系,进一步支持ALYREF作为17q21-ter获得和MYCN-扩增之间合作的关键中介在恶性神经母细胞瘤表型中的作用。
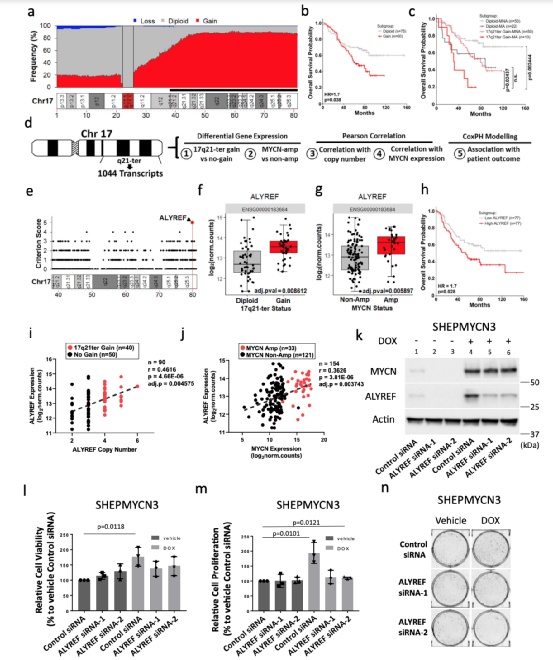
MYCN以ALYREF依赖性方式增加神经母细胞瘤细胞的活力
ALYREF主要诱导MYCN过表达的细胞增殖,但并不协助MYCN调节细胞存活。通过Alamar Blue测定法测定,所有神经母细胞瘤细胞中ALYREF的内源性敲除伴随着细胞活力的显著下降。
MYCN直接上调ALYREF的转录
在TARGET、SEQC和Kocak神经母细胞瘤患者肿瘤数据集中,高ALYREF mRNA表达与MYCN mRNA表达相关。在MYCN扩增和MYCN过表达的人神经母细胞瘤细胞中,ALYREF蛋白的表达水平很高,与人成纤维细胞相比,其表达水平明显更高。
ALYREF与MYCN参与正向互连的调节信号轴
数据表明,ALYREF通过抑制其蛋白降解来维持MYCN的高水平表达。在MYCN扩增的神经母细胞瘤细胞中,用ALYREF siRNA-1或ALYREF siRNA-2沉默内源性ALYREF显著降低了MYCN蛋白的表达,然而,敲除ALYREF对MYCN mRNA水平没有影响。
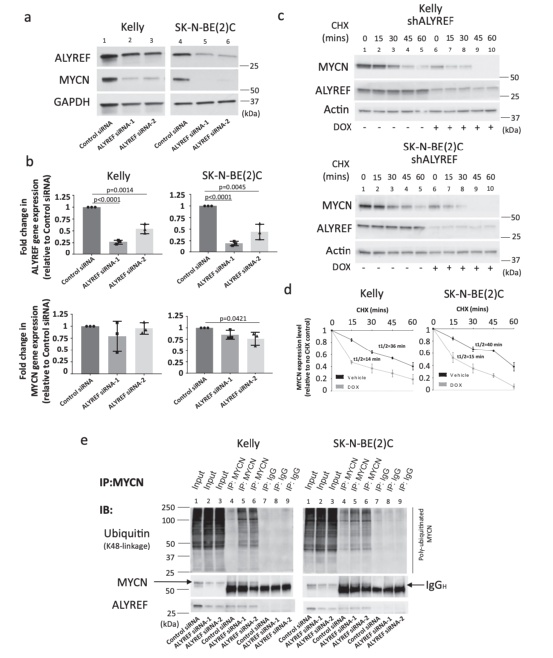
ALYREF在细胞核中与MYCN形成蛋白复合物
用HA标记抗体对细胞总蛋白进行MYCN共免疫沉淀(co-IP),结果显示ALYREF结合MYCN。通过离心分离细胞总蛋白,MYCN和ALYREF都主要集中在MYCN扩增的神经母细胞瘤细胞系(Kelly和SK-N-BE)中的细胞核。研究数据表明,MYCN的一个小区域包含281-345位氨基酸对于与ALYREF的结合至关重要。
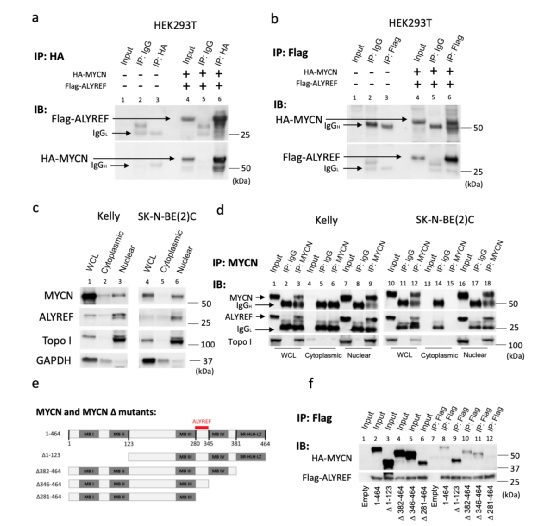
ALYREF和MYCN形成转录激活剂复合物,上调USP3的表达
研究人员发现共有3598个ALYREF结合位点,确定了194个正在进行转录的ALYREF调控基因,其中57个基因的FE超过5(图b)。从这57个基因中,确定泛素特异性蛋白酶3基因(USP3)满足所有标准(图a)。

USP3通过其脱泛素酶活性调节MYCN的表达
研究人员发现SEQC神经母细胞瘤患者队列中USP3 mRNA的高表达也与不良预后相关。重要的是,高USP3 mRNA表达与MYCN表达相关。总生存期和无事件生存期的多变量分析显示,与其他预后因素(如患者年龄、临床阶段和MYCN-扩增)相比,高USP3表达没有独立的预后意义。进一步分析说明USP3在恶性神经母细胞瘤细胞表型中的作用依赖于MYCN-ALYREF调节复合物。
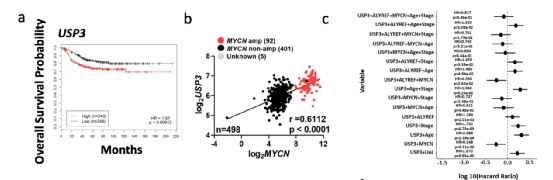
USP3负责ALYREF诱导的MYCN稳定性
USP3是MYCN-ALYREF-USP3信号对神经母细胞瘤细胞活力和MYCN稳定性影响的效应蛋白。
ALYREF是MYCN扩增的神经母细胞的生长和致瘤性所必需的
ALYREF在体外和体内都促进MYCN定向的肿瘤发生。抑制ALYREF可降低ALYREF和MYCN的表达水平;敲除ALYREF对神经母细胞瘤细胞的癌症表型有深远的影响。

总之,通过对神经母细胞瘤细胞的研究,Marshall教授和他的团队发现,ALYREF直接与MYCN结合,开启另一种蛋白USP3,防止MYCN被降解。这就维持了驱动癌症所需的极高水平的MYCN,所以起到了加速器的作用。这些研究结果表明,ALYREF抑制可以中断这种循环,并被证明是一种非常有价值的高危神经母细胞瘤的新治疗策略。
研究人员表示:"这项研究提供了新的知识作为药物发现的基础,一旦找到合适的候选药物,就可以在肿瘤中含有高水平MYCN和ALYREF的儿童中进行临床试验。"
令人兴奋的是,靶向ALYREF也可能被证明是一种有用的治疗策略,适用于其他类型的癌症,这些癌症,如高危神经母细胞瘤,已知是MYCN驱动的。这些癌症包括血癌、髓母细胞瘤、胶质母细胞瘤、视网膜母细胞瘤、卵巢癌、Wilms肿瘤和神经内分泌前列腺癌。需要进一步研究探索这一潜力。
参考资料:
1、儿童神经母细胞瘤诊疗规范(2019年版)
2、Zsuzsanna Nagy et al. An ALYREF-MYCN coactivator complex drives neuroblastoma tumorigenesis through effects on USP3 and MYCN stability, Nature Communications (2021). DOI: 10.1038/s41467-021-22143-x