近日,一篇发表在国际杂志Nature上的研究报告中,来自英国埃克塞特大学医学院等机构的科学家们通过研究识别出了近300个基因突变或影响着女性的生殖寿命。此外,通过对小鼠进行研究,研究人员成功操控了多个与延长其生殖寿命的突变的相关关键基因。相关研究结果有望帮助增加科学家们对生殖衰老过程的理解,并能提供新方法来改善预测哪些女性可能要比其它女性更早地进入绝经期。

图片来源:https://www.nature.com/articles/s41586-021-03779-7
尽管在过去150年里人们的预期寿命发生了明显增加,但大多数女性进入自然绝经期的年龄一直稳定在50岁左右。女性在出生时就携带有其所有的卵子,而这些卵子会随着其年龄的增长而不断衰老,一旦大部分卵子消失女性就会出现绝经,这样其自然生育的能力就会明显下降。
研究者Eva Hoffmann说道,修复卵子中受损的DNA对于建立女性出生时的卵子库以及改善其在整个生命阶段流失的速度至关重要,而改善参与生殖衰老的生物学过程的理解或能帮助改善人类的生育疗法。
这篇研究报告中,研究人员识别出了与生殖寿命相关的新型遗传突变,从而使得已知的遗传突变的数量从56个增加到了290个。这些发现是通过分析来自许多研究中的数十万名女性的数据集而实现的,包括英国生物样本库和23andMe。23andMe的数据则是由选择参与研究的客户所提供的,尽管大部分的数据来自于欧洲血统的女性,但研究人员也分析了近8万名东亚血统女性的数据,并发现了大致相似的结果。
研究者发现,很多关联性的基因都与DNA修复过程直接相关。此外,其中很多基因在机体出生前就已经处于活性状态了,而且在机体整个生命阶段都是如此。值得注意的是来自两个细胞周期检查点通路的基因CHEK1和CHEK2,其能帮助调节多种多样的DNA修复过程,敲除一个特定的基因(CHEK2)使得其不再能够发挥作用,并过度表达另一个基因(CHEK1)则能增强其活性,这两种策略都能使得小鼠的生殖寿命延长大约25%。
小鼠的生殖生理学在关键方面也与人类不同,比如小鼠并没有绝经期。然而,本文而研究中,研究人员还分析了天然缺失活性CHEK2基因的女性,结果发现,相比携带正常活性基因的女性而言,该基因缺失的女性进入绝经期要晚3.5年。
研究者Ignasi Roig说道,能够产生参与修复受损DNA蛋白的基因中有两个基因在小鼠生殖力方面能以相反的方式来发挥作用,携带更多CHEK1蛋白的雌性小鼠出生时就携带有更多的卵子,其就需要更长的时间来自然消耗,因此生殖寿命相对较长。然而,第二种名为CHEK2的基因也具有类似的效果,即使得卵子的存活时间更长,但在这种情况下,该基因已经被敲除,因此并不会有蛋白质产生,这就表明,CHEK2的激活会引发成体小鼠的卵细胞死亡。本文研究中,研究人员所识别的基因影响着机体自然绝经的年龄,同时还能被用来预测哪些女性会在年轻时经历较高风险的绝经。
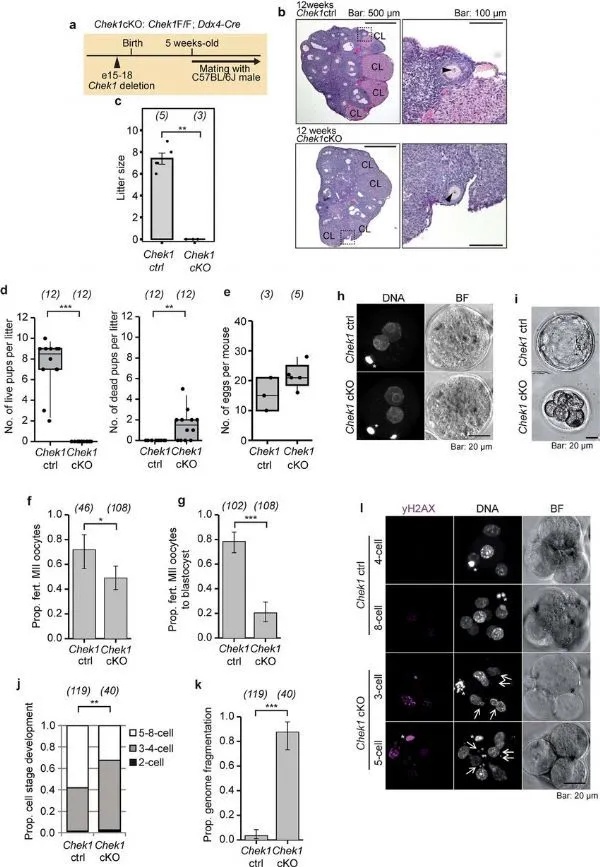
由于胚胎在发育阶段需要Chek1,因此条件性敲除Chek1后就会使得雌性无法生育。
图片来源:Ruth, K.S., et al. Nature (2021). doi:10.1038/s41586-021-03779-7
研究者Katherine Ruth说道,我们希望本文研究能提供更多可能性来帮助女性规划其生育计划,通过找到更多导致绝经时间变化的遗传原因,如今研究者就能提前预测哪些女性可能会提前绝经从而难以自然怀孕。研究人员使用了一种检测自然发生遗传差异影响的方法来分析绝经期提前或推后给女性机体健康所带来的影响;结果发现,在遗传上更早的绝经期会增加2型糖尿病的风险,同时还与较差的骨骼健康和骨折风险增加有关;然而其却能降低女性患某些癌症的风险,比如卵巢癌和乳腺癌,这些癌症对性激素较为敏感。
研究者认为,本文研究结果非常重要,虽然后期他们还有很长一段路要走,但通过将对人类的遗传分析和对小鼠进行的研究相结合,以及分析相关基因何时会在人类卵子中被开启表达,如今他们对人类生殖衰老有了更深入的理解,这也能帮助人类避免一些与绝经时间相关的健康问题。
综上,本文研究结果揭示了卵巢衰老的分子机制,即其何时会发挥作用,同时研究者还阐明了如何通过治疗性的方法来靶向作用从而延长人类的生育力以及预防疾病的能力。
原始出处:
Ruth, K.S., Day, F.R., Hussain, J. et al. Genetic insights into biological mechanisms governing human ovarian ageing. Nature (2021). doi:10.1038/s41586-021-03779-7