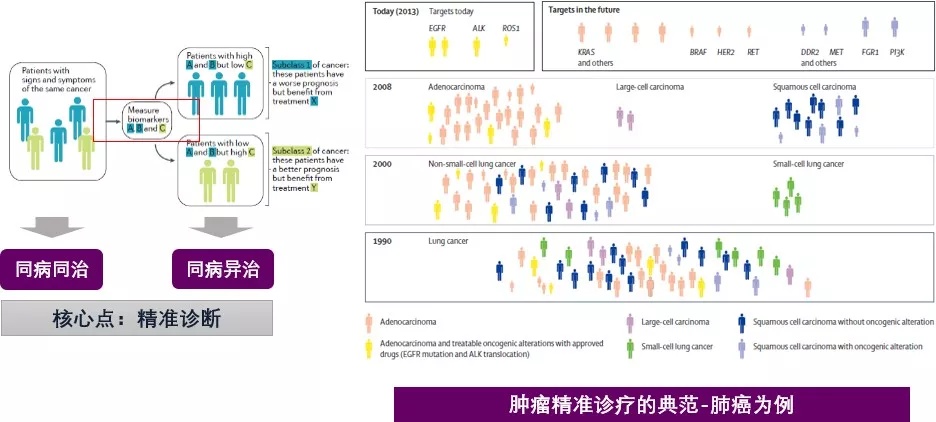
目前对于非小细胞肺癌(NSCLC),尤其是对于晚期腺癌或含腺癌成分的其他类型肺癌,在诊断的同时进行基因检测,通过基因检测可以筛选出更有效的治疗方案,降低药物毒副作用,如 EGFR 突变阳性患者一线治疗应使用表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),疗效更好,且避免过多使用化疗药物[2]。
多基因检测指导晚期 NSCLC 治疗

今年的 NCCN NSCLC 临床实践指南(2020.V2)[3]明确晚期 / 远处转移的 NSCLC 患者需进行表皮生长因子受体(EGFR)、间变淋巴瘤激酶(ALK)、活性氧以及 PD-L1 这四个基因靶点检测,均为 1 类证据推荐。
✦ 权威指南要求明确驱动基因——单基因到多基因,同一基因单次到多次检测


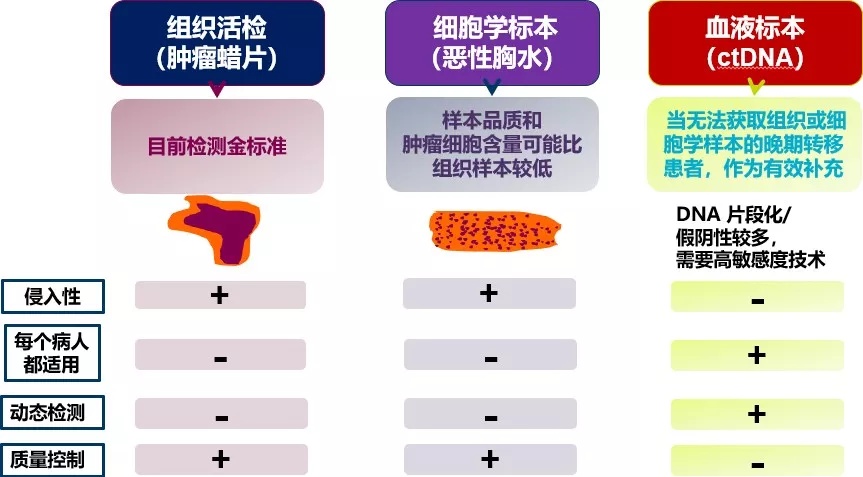
在我国有超 50% 的 NSCLC 患者存在 EGFR 突变,远超欧美患者[4]。因此在近几年,我国的 EGFR 检测率迅速提升[5]。临床常用的 EGFR 检测的样本来源于组织活检、细胞学样本、血液标本。组织活检是金标准,细胞学标本其次,对于组织和胸水都取不到的患者, 血液样本获取便利,是一个很好的补充[6~7]。
除了取材便利,液体活检也有自己的优势:可以克服肿瘤异质性,便于动态监测,从而预测转移复发风险,研究耐药机制等[8]。
EGFR 检测样本来源
NCCN 指南[3]对同一基因的检测推荐由单次发展为多次,例如在针对 EGFR TKI 一线治疗进展的患者进行的二次 T790M 检测。而对驱动基因的血浆动态监测可成为未来发展的方向。
BENEFIT 研究数据显示[9],在疾病临床进展前,血浆检测即可出现获得性 T790M 突变,中位时间为 7.6 个月,从血浆检测 T790M 阳性至疾病进展的中位时间为 2.0 个月。另外,在第 8 周,EGFR 突变清除者(88%)具有更长的无进展生存期(PFS)(11 个月 vs. 2.1 个月,HR = 7.28,P < 0.0001)。由此可见,驱动基因的动态血浆监测可早于影像学进展前发现耐药突变,并且可以帮助对患者的预后做出判断。
✦ 驱动基因动态血浆监测早于影像学进展前发现耐药突变
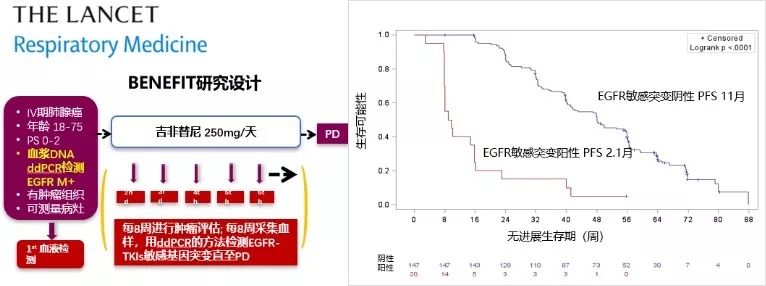
除此以外,TKI 治疗中动态血浆监测还有助于明确耐药机制[10]。
目前指南推荐的靶向治疗都是针对单个基因突变,但是即使都是 EGFR 敏感突变的患者, 由于伴发基因突变的不同,TKI 治疗的疗效也有区别。
2012~2014 年的一项回顾性队列研究[11],纳入了 58 例接受 EGFR-TKIs 治疗的EGFR 突变转移性NSCLC 患者,通过第二代测序分析,涵盖 49 个癌症相关基因,由逻辑回归分析确定药物反应和共存突变之间的关联。从研究结果可以看出有伴发突变的患者 PFS 和总生存时间(OS)明显缩短。这意味着,即使在一线 EGFR 敏感突变阳性这一有明确靶向用药策略的人群中,基线的突变谱全景依然具有重要的临床价值。
是否带有伴发突变对肺癌患者的 PFS 和 OS 影响明显

无进展生存期更短(6.20 个月 vs. 18.77 个月; HR = 3.51; P < 0.001) 总生存期较短(22.70 个月 vs. 未达到; HR = 4.65; P < 0.001)
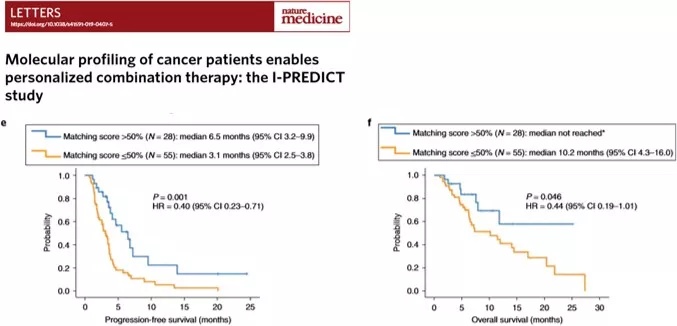
因此对于驱动基因阳性的患者通过多基因检测进一步细分治疗方案,有助于预后的改善。在 2019 年的 Letters 上发表的一研究数据表明[12],83 例晚期转移性、难治性肿瘤患者, 经 FoundationOne 全基因组分析后,在 25 个月时,高度匹配个体化联合治疗 57.9% 存活;另一组只有 14.4%。所以多基因的靶向药物联合治疗能显著延长 NSCLC 患者的生存期,提高患者生存质量。
多基因靶向药物联合治疗显著延长生存期
小结
1. EGFR 是我国 NSCLC 患者最常见的驱动基因,但 EGFR 检测率仍有待进一步改善。
2. NCCN 推荐 EGFR、ALK、ROS1、PD-L1 的检测为 1 类证据推荐。
3. 驱动基因动态血浆监测可早于影像学进展前发现耐药突变,预测 TKI 疗效,及时明确耐药机制,调整治疗。
4. 靶向药物联合治疗能显著延长 NSCLC 患者的生存期,提高患者生存质量。
2021-11-12 CN-68497
参考文献
[1]. 郭楠楠,刘阳,张文,赵英男.非小细胞肺癌个体化分子靶向治疗研究进展[J].北京医学,2017,39(03):286-290.
[2]. 官绍年,陈迎珠,卓明磊,贾淑芹,王国洪,徐国宾.非小细胞肺癌EGFR基因突变检测的临床应用进展[J].临床检验杂志,2020,38(02):130-136.
[3]. NCCN Guidelines Version 2.2020 Non-Small Cell Lung Cancer
[4]. 刘宗超,李哲轩,张阳,周彤,张婧莹,游伟程,潘凯枫,李文庆.2020全球癌症统计报告解读[J].肿瘤综合治疗电子杂志,2021,7(02):1-14.
[5]. 中国非小细胞肺癌患者EGFR T790M基因突变检测专家共识[J].中华医学杂志,2018,98(32):2544-2551.
[6]. Di Capua Daniel,BrackenClarke Dara,Ronan Karine,Baird AnneMarie,Finn Stephen. The Liquid Biopsy for Lung Cancer: State of the Art, Limitations and Future Developments.[J]. Cancers,2021,13(16):
[7]. Shido T, Okita G, Asakura K, et al.96O*Determining the prevalence of EGFR mutation in asian and russian patients with advanced non-small cell lung cancer of adenocarcinoma and nonadenocarcinoma histology:IGNITE study[J].Annals of Oncology, 2015, 26 (suppl 1) :i29-i30.
[8]. 郑迪凡,陈海泉.液体活检及其在非小细胞肺癌诊治中的研究进展[J].中国肺癌杂志,2016,19(06):394-398.
[9]. Wang Z, et al. Detection of EGFR mutations in plasma circulating tumour DNA as a selection criterion for first-line gefitinib treatment in patients with advanced lung adenocarcinoma (BENEFIT): a phase 2, single-arm, multicentre clinical trial. Lancet Respir Med. 2018 Jul 12.
[10]. 周清, 血浆游离DNA中EGFR突变的动态定量检测预测EGFR-TKI疗效和耐药的研究. 广东省,广东省人民医院,2018-08-01.
[11]. Shaodong Hong, et al. Concomitant Genetic Alterations With Response to Treatment and Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors in Patients With EGFR-Mutant Advanced Non-Small Cell Lung Cancer. JAMA Oncol. 2018. doi: 10.1001/jamaoncol.2018.0049
[12]. Sicklick JK, Kato S, Okamura R, et al. Molecular profiling of cancer patients enables personalized combination therapy: the I-PREDICT study. Nat Med. 2019;25(5):744-750. doi:10.1038/s41591-019-0407-5.