故事就这样结束了?
不能,主角还没登场呢,本期的主角是ctDNA-MRD。
在多种实体肿瘤类型中,使用ctDNA作为肿瘤负荷的生物标志物是一个新兴领域。在早期癌症中,ctDNA阳性被认为是微小/分子残留病灶(MRD)的可能证据。2,3 新的证据表明,ctDNA的存在早于影像学的复发,而ctDNA的动态变化与治疗反应相关。4,5
2021年6月16日,《Nature》发表了IMvigor010研究中ctDNA-MRD预测能力的探索性生物标志物分析结果,结果表明:个体化ctDNA分析不仅可以高度准确地识别微小/分子残留病灶(MRD),还可以预测免疫疗法的治疗结果。6

研究人员评估了IMvigor010(NCT02450331)的临床辅助试验,对581名参与研究的患者进行了前瞻性的ctDNA分析(ctDNA状态在手术后和治疗开始前(C1D1,术后中位79天)以及治疗方案的第6周(C3D1)进行评估),比较了阿替利珠单抗与手术切除后观察对可手术尿路上皮癌患者的影响。
该研究的MRD检测:
采用Natera公司的signatera MRD检测产品(Tumor-informed assay):
1)WES(靶向19,500基因外显子,500ng gDNA)检测肿瘤组织(有效180X)和正常对照组织(有效50X);
2)使用Natera开发的共识变异调用(过滤胚系及分析克隆演化)方法筛选16个突变位点进行扩增子方法的血浆ctDNA检测,测序深度为100,000X;
3)16个突变中观察到至少两个或两个以上(≥2/16),被认为是ctDNA-MRD阳性,LoD可达0.01%(sample-level水平,20-30ng血浆cfDNA即可);
4)整个TAT:3-4周。
该研究的主要结果:
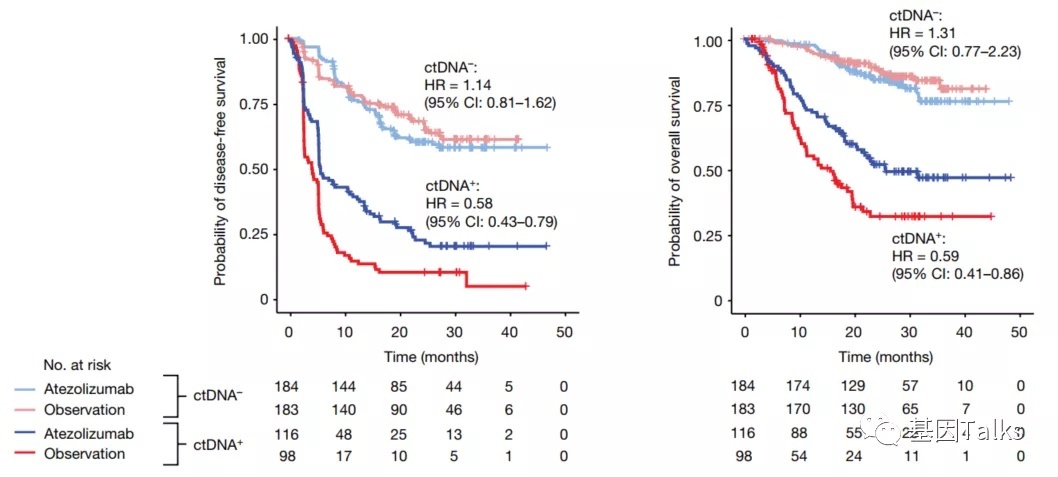
1)术后C1D1检测,ctDNA-MRD呈阳性的患者比ctDNA-MRD呈阴性的患者有更高的癌症复发风险;
2)术后ctDNA-MRD阳性患者(37%)获得了显著的治疗益处,无病生存率(DFS)提高了42%(5.9个月vs 4.4个月,HR=0.58),总生存率(OS)提高了41%(25.8个月vs 15.8个月,HR=0.59);
3)术后ctDNA-MRD阴性患者(63%)未获得治疗益处,无需接受阿替利珠单抗的辅助治疗;
患者术后ctDNA状态评估
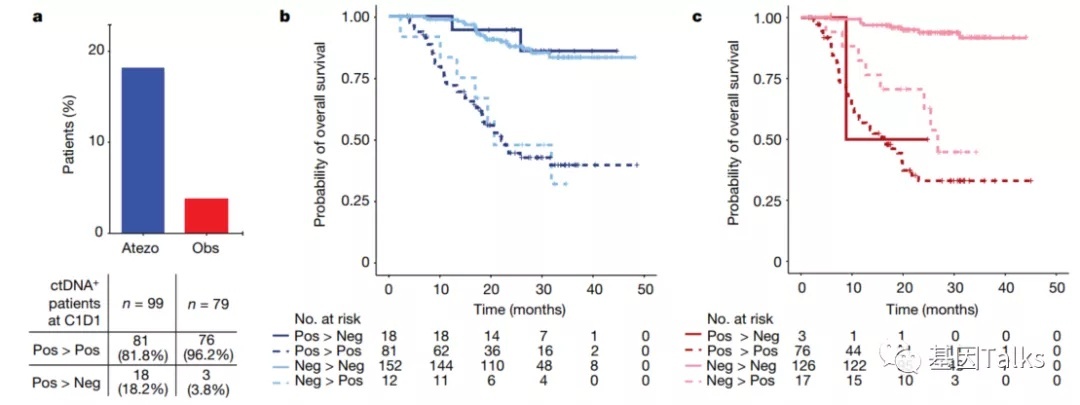
4)与观察组的ctDNA清除率(3.8%)相比,治疗组的ctDNA清除率(18.2%)更高,表明ctDNA状态/清除率可以作为治疗反应的早期指标;
阿替利珠单抗辅助治疗和ctDNA清除及OS分析
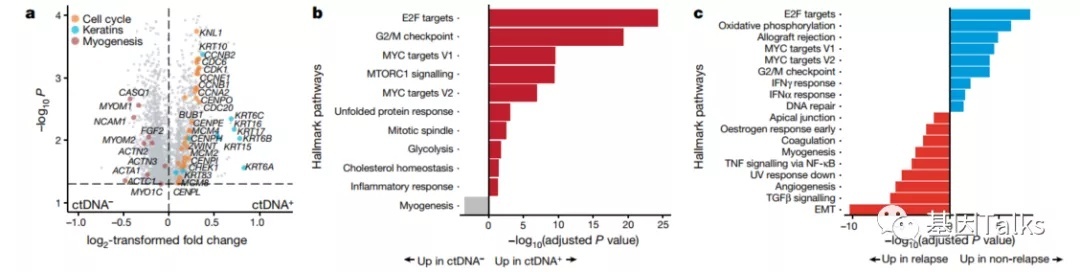
5)对阿替利珠单抗有反应的患者与无反应的患者具有不同的RNA特征。ctDNA阳性患者的肿瘤转录组学分析发现,细胞周期和角蛋白基因表达水平更高。对于ctDNA阳性并接受阿替利珠单抗治疗的患者,不复发的原因可能与免疫反应和基底鳞片基因特征有关,而复发原因可能与血管生成和成纤维细胞TGFβ特征有关。
ctDNA阳性人群中免疫应答的转录相关生物标志物
下面,
我们通过PPT的形式,
进一步认识这篇Nature中ctDNA-MRD的意义:

2021年6月16日,《Nature》发表了这篇题目为“ctDNA指导尿路上皮癌辅助免疫疗法”的文章,这一研究结果有望改变早期癌症术后护理的标准。
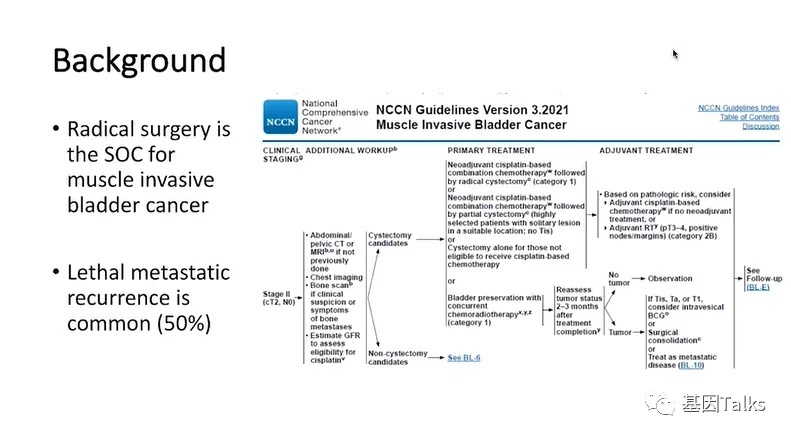
NCCN指南指出,根治性手术是肌层浸润性膀胱癌的基(标)本(准)治疗方法,但致命的转移性复发非常常见,占到50%。因此,如果能识别在手术治疗后可能有微小/分子残留病灶的高复发风险患者并提前进行干预将会非常有临床意义。但目前的影像学也只能检测到肉眼可见的病灶。
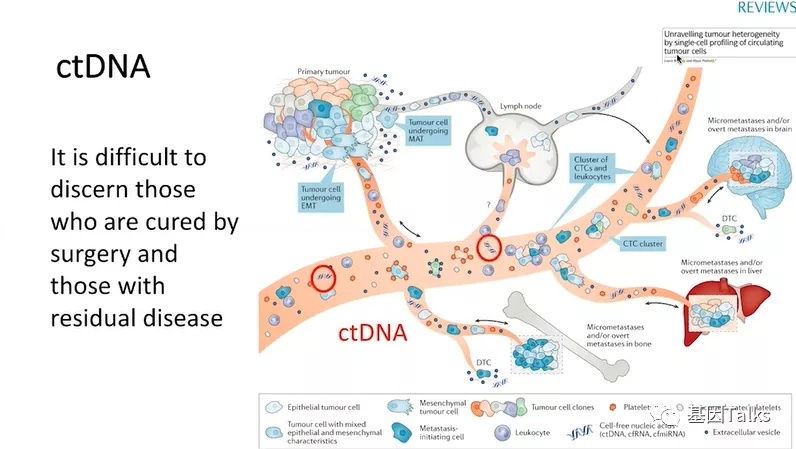
因此,识别微小/分子残留病灶的一种方法是寻找ctDNA,即循环肿瘤DNA,它是由肿瘤细胞坏死或凋亡后释放到血液中的游离DNA片段。

在过去的几年里,实际上,在过去的六个月左右的时间里,我们看到了两项关于尿路上皮癌使用辅助免疫疗法的试验数据发表,其中一个是IMvigor010(研究阿替利珠单抗的辅助治疗),另一个是CheckMate-274(研究纳武利尤单抗的辅助治疗),这两个是相对相似的设计,研究MIUC患者并将他们随机分配到辅助治疗或手术切除后观察中。
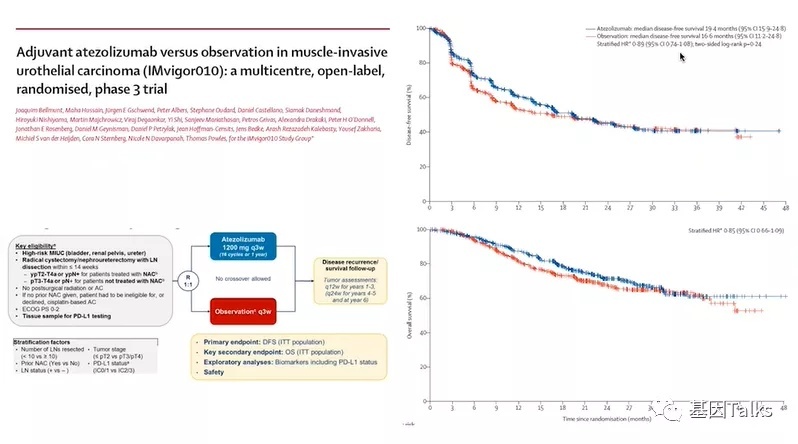
聚焦今年三月份《柳叶刀·肿瘤学》杂志发表的III期IMvigor010研究结果,我们可以从右上角的DFS和右下角的OS曲线看到,没有证据表明添加阿替利珠单抗的辅助治疗能有显著获益。故事就这样结束了?

我们能否换个角度来评估呢?如ctDNA-MRD阳性复发可能性较高的患者是否可以从阿替利珠单抗的辅助治疗中临床获益呢?而ctDNA-MRD阴性复发可能性较低的患者不能免疫治疗获益呢?
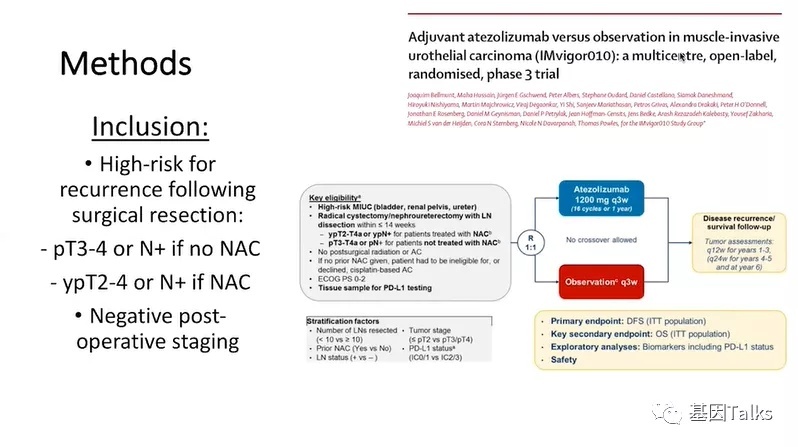
简单重申一下,该试验包括手术切除后高风险的患者,对于未接收新辅助治疗(NAC)的患者,定义为PT3-4或淋巴结阳性;对于接受新辅助治疗(NAC)的患者,定义为ypT2-4或淋巴结阳性,并且他们的术后分期必须为阴性。

此文进行了肿瘤患者的分子分析,包括肿瘤组织,正常组织和血浆。
【方法】肿瘤组织分析和测序:首先从手术标准中提取了DNA,进行了WES检测(对肿瘤组织和正常组织进行WES检测,捕获19,500个基因,然后mapping hg19进行分析),并进行了PD-L1表达的检测(VENTANA SP142 IHC saasy,IC≥5%为PD-L1表达阳性)。

【方法】血浆ctDNA分析设计:使用Natera开发的共识变异调用(过滤胚系及分析克隆演化)方法筛选16个突变位点进行扩增子方法的血浆ctDNA检测,测序深度为100,000X。16个突变中观察到至少两个或两个以上(≥2/16),被认为是ctDNA-MRD阳性,LoD可达0.01%(sample-level水平,20-30ng血浆cfDNA即可)。

【方法】统计学分析:
目标:
#1:对于辅助治疗前C1D1检测到ctDNA-MRD阳性的患者,阿替利珠单抗的辅助治疗能否提高DFS?
#2:对于辅助治疗前C1D1检测到ctDNA-MRD阳性的患者,DFS是否会下降?
#3:对于两周期治疗后C3D1检测到ctDNA-MRD阳性的患者,DFS是否会下降?
#4a:对于两周期治疗后C3D1检测到ctDNA清除,是否会提高DFS?
#4b:ctDNA的清除是否在接受阿替利珠单抗单抗辅助治疗的患者中更为常见?
初步分析:ctDNA分类(即ctDNA-MRD阳性/阴性)
次要终点:总生存率(OS)
次要暴露:临床/病理特征,PD-L1,TMB以及RNA-seq等分子基因特征。

我们可以看到809名患者参加了IMvigor010试验,最终619名患者具有肿瘤DNA,至少有一个与正常 DNA匹配血浆样品可用。随后往下看,你可以看到581名患者对C1D1血浆进行了ctDNA检测评估并通过了质量控制。然后将这些患者分为观察组的281名患者和阿替利珠单抗组的300名患者,并可进行ctDNA-MRD的生物标志物评估。
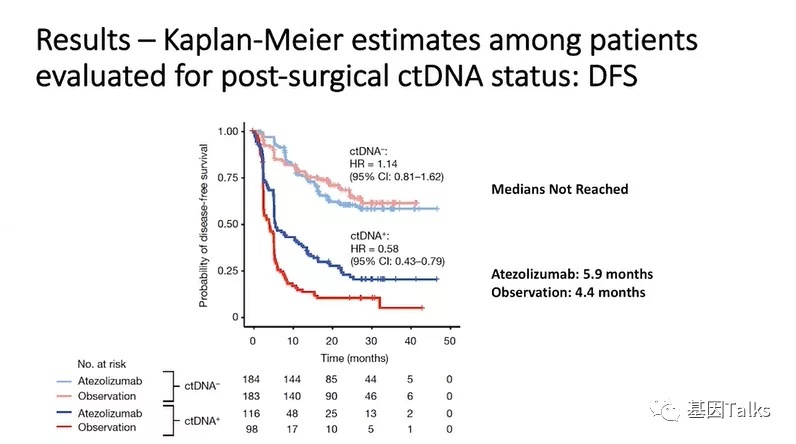
从研究的主要结果来看,这是经过评估的术后ctDNA状态患者的Kaplan-Meier估计值,特别是DFS,术后ctDNA-MRD阳性的患者接受阿替利珠单抗治疗后,DFS提高了42%(5.9个月vs 4.4个月,HR=0.58),反观术后ctDNA阴性的患者接受阿替利珠单抗治疗后,DFS并没有明显变化。这张slides应该是此次PPT里面最重要的一张了。
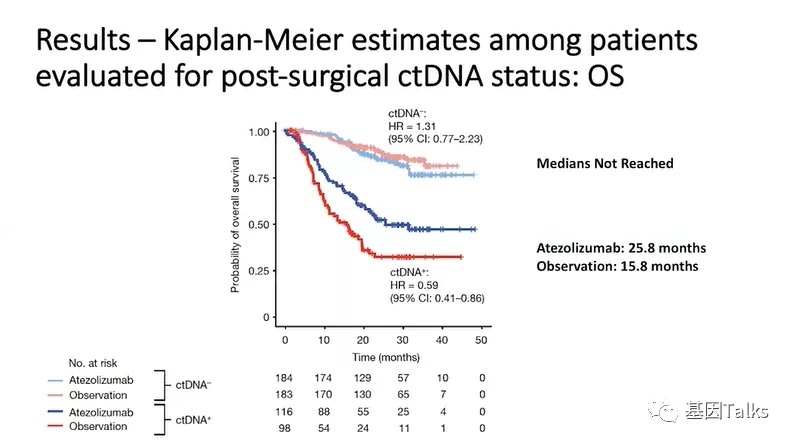
次要终点OS分析可见,术后ctDNA-MRD阳性的患者接受阿替利珠单抗治疗后,OS提高了41%(25.8个月vs 15.8个月,HR=0.59),反观术后ctDNA阴性的患者接受阿替利珠单抗治疗后,OS并没有明显变化。
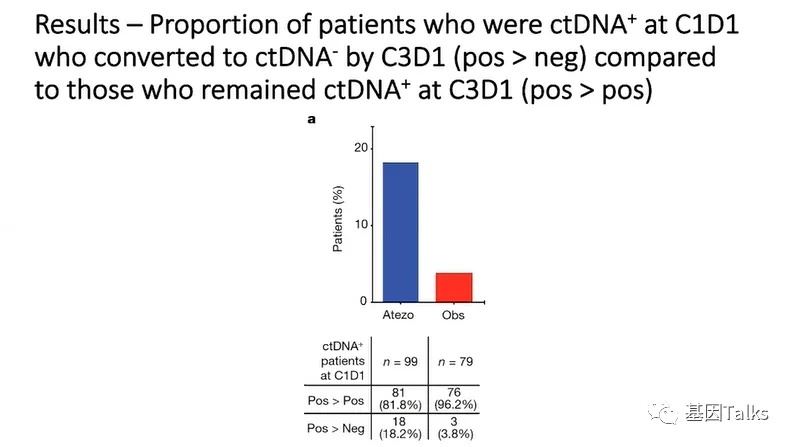

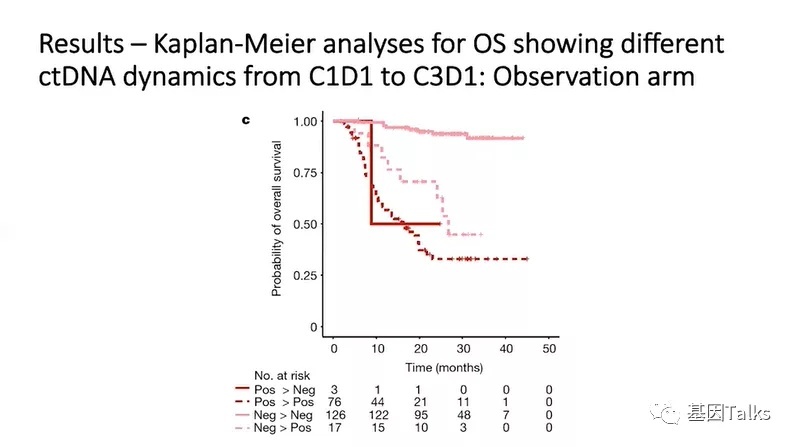
与观察组的ctDNA清除率(3.8%)相比,治疗组的ctDNA清除率(18.2%)更高,而且这部分患者相比MRD未转阴患者具有更长的总生存获益,表明ctDNA状态/清除率可以作为治疗反应的早期指标。
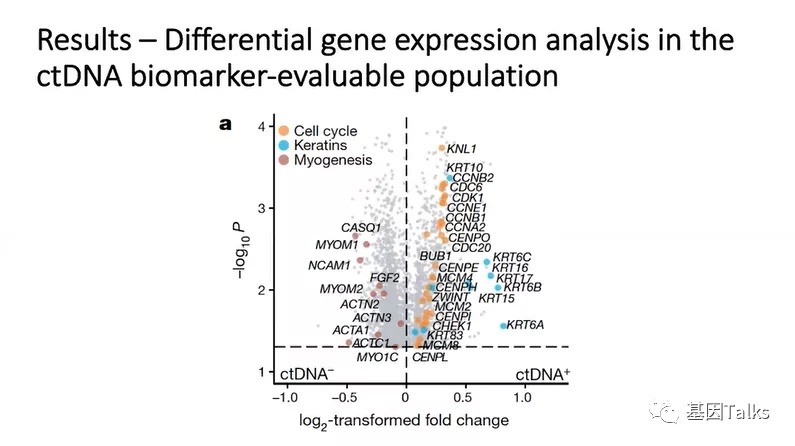
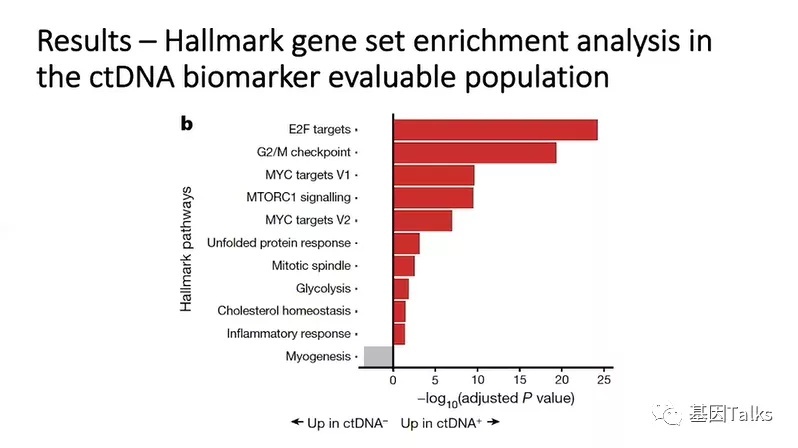
另外,对阿替利珠单抗有反应的患者与无反应的患者具有不同的RNA特征。ctDNA阳性患者的肿瘤转录组学分析发现,细胞周期和角蛋白基因表达水平更高。对于ctDNA阳性并接受阿替利珠单抗治疗的患者,不复发的原因可能与免疫反应和基底鳞片基因特征有关,而复发原因可能与血管生成和成纤维细胞TGFβ特征有关。

讨论重点:
从这项研究来看,在识别分子残留病灶(MRD)的基础上启动个体化诊疗(而不是治疗未选择的患者或等待复发)将是癌症治疗的一个重大变化;
该分析确定了一个高危患者群体(ctDNA-MRD+),这些患者可能在手术后有分子/微小残留病灶,并且似乎通过阿替利珠单抗的辅助治疗后可获益(18%的患者C3D1清除了ctDNA);
其他辅助免疫治疗研究,例如CheckMate 274,在未选择的PD-L1阳性患者中显示出DFS的益处,但总体OS未获益。有趣的是,正如作者在讨论中所讨论的那样,可能需要一种个性化的方法来选择具有ctDNA-MRD的患者进行免疫治疗,以证明我们在本研究中看到的总体生存获益。

结论:
总而言之,这些发现证明了ctDNA可作为分子/微小残留病灶(MRD)的生物标志物,即认同了ctDNA-MRD(将ctDNA与肿瘤生物学联系起来),以提示阿替利珠单抗辅助治疗的应答。这些结果可能会改变我们对癌症术后护理的理解,并且在这种情况下以及其他肿瘤类型中得到验证的话,该发现也将改变临床的实践。
参考资料:
1.J. Bellmunt et al., Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 22, 525-537 (2021).
2.Chin, R. I. et al. Detection of solid tumor molecular residual disease (MRD) using circulating tumor DNA (ctDNA). Mol. Diagn. Ther. 23, 311–331 (2019).
3.Christensen, E. et al. Early detection of metastatic relapse and monitoring of therapeutic efficacy by ultra-deep sequencing of plasma cell-free DNA in patients with urothelial bladder carcinoma. J. Clin. Oncol. 37, 1547–1557 (2019).
4.Bratman, S. V. et al. Personalized circulating tumor DNA analysis as a predictive biomarker in solid tumor patients treated with pembrolizumab. Nat. Cancer 1, 873–881 (2020).
5.Zhang, Q. et al. Prognostic and predictive impact of circulating tumor DNA in patients with advanced cancers treated with immune checkpoint blockade. Cancer Discov. 10, 1842–1853 (2020).
6.Powles Thomas,Assaf Zoe June,Davarpanah Nicole et al. ctDNA guiding adjuvant immunotherapy in urothelial carcinoma.[J] .Nature, 2021, 595: 432-437.