相关研究结果于2021年9月6日在线发表在Nature期刊上,论文标题为“Programmable RNA targeting with the single-protein CRISPR effector Cas7-11”。

论文共同通讯作者、麦戈文研究所研究员Omar Abudayyeh提及通过使DNA编辑变得快速、廉价和精确而引发现代生物学变得的DNA切割酶Cas9时,说道,“这种新的细菌酶就像是编辑RNA的Cas9。”他补充说,“它精确地在靶标上进行两次切割,而且不会像其他酶那样在切割过程中破坏细胞。”
到目前为止,只有另外一个RNA靶向酶家族,即Cas13,被广泛地开发用于RNA靶向应用。然而,当Cas13识别到它的目标时,它会粉碎细胞中的任何RNA,从而顺便地破坏细胞。与Cas9一样,Cas7-11是一个可编程系统的一部分;它可以通过CRISPR向导指向特定的RNA靶标。Abudayyeh、麦戈文研究员Jonathan Gootenberg(另一名论文共同通讯作者)和他们的同事们通过对微生物世界中发现的CRISPR系统的深入探索发现了Cas7-11。
探索自然多样性
与其他CRISPR蛋白一样,Cas7-11被细菌用来作为防御病毒的机制。在遇到一种新的病毒后,采用CRISPR系统的细菌以病毒遗传物质的小片段形式记录病毒感染。如果该病毒再次出现,CRISPR系统就会被激活,在一小段RNA的引导下,摧毁病毒基因组并消除感染。这些古老的免疫系统是广泛而多样的,不同的细菌部署不同的蛋白质来对抗它们的病毒入侵者。
论文共同作者、美国国家生物技术信息中心进化生物学家Eugene Koonin说,“有些CRISPR蛋白靶向DNA,有些CRISPR蛋白靶向RNA。有些CRISPR蛋白在裂解靶标方面非常有效,但有一些毒性,而另一些则没有。它们引入了不同的切割类型,它们可以在特异性方面有所不同--等等。”
Abudayyeh、Gootenberg和Koonin一直在研究基因组序列,以了解CRISPR系统的自然多样性,并作为潜在的工具分析它们。Abudayyeh说,这个想法是为了利用进化已经在改造蛋白质机器上完成的工作。
当这些作者通过公共数据库来研究不同细菌防御系统的组成部分时,一种从日本东京湾分离出来的细菌Desulfonema ishimotonii的蛋白质引起了他们的注意。它的氨基酸序列表明,它属于一类CRISPR系统,该系统使用大型的多蛋白复合物来寻找和切割它们的目标。但是这种蛋白质似乎拥有它所需要的一切,可以独立完成这项任务。Koonin说,其他已知的单蛋白Cas酶,包括已被广泛用于DNA编辑的Cas9蛋白,属于CRISPR系统的一个单独类别,但是Cas7-11模糊了CRISPR分类系统的界限。他们最终将这种蛋白质命名为Cas7-11。
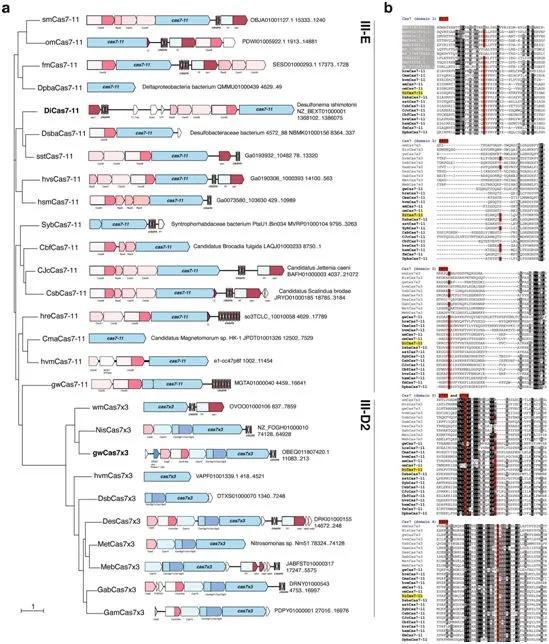
额外的III-E型家族成员和新颖的III-D2型位点结构和具有代表性的同源物的多重比对。图片来自Nature, 2021, doi:10.1038/s41586-021-03886-5
Cas7-11从工程的角度来看是很有吸引力的,因为单一的蛋白质更容易被递送到细胞中,并且比复杂的多蛋白复合物更容易成为编辑工具。但是它的组成也标志着一个意想不到的进化史。这些作者发现有证据表明,通过进化,更复杂的Cas机器的组件融合在一起,形成了Cas7-11蛋白。Gootenberg将此等同于当你之前认为鸟类是唯一会飞的动物时发现了蝙蝠,从而认识到有多种进化路径来实现飞行。他说,“这完全改变了人们对CRISPR系统的思考方式,无论是在功能上还是在进化上。”
精确编辑
当Gootenberg和Abudayyeh在他们的实验室里生产出Cas7-11蛋白并开始对它进行实验时,他们意识到这种不寻常的酶提供了一种操纵和研究RNA的强大手段。当他们把它和向导RNA(gRNA)一起引入细胞时,它精确地切割了它的RNA靶标,而其他RNA却没有受到干扰。这意味着他们可以使用Cas7-11来改变RNA代码中的特定碱基,从而校正基因突变带来的错误。他们还能够对Cas7-11进行编程,以稳定或破坏细胞内的特定RNA分子,这使他们有能力调整这些RNA编码的蛋白质的水平。
Abudayyeh和Gootenberg还发现,Cas7-11切割RNA的能力可以被一种似乎可能也参与触发程序化细胞死亡的蛋白质所抑制,这表明CRISPR防御和对感染的更极端反应之间可能存在联系。
这些作者发现,一种基因治疗载体可以将完整的Cas7-11编辑系统递送给细胞,而且Cas7-11不会损害细胞的健康。他们希望随着进一步的开发,这种酶有一天可能被用来编辑患者RNA中的致病序列,这样他们的细胞能够产生健康的蛋白质,或者下调因遗传疾病而造成伤害的蛋白质的水平。
Gootenberg说,“我们认为Cas7-11的独特切割方式能够实现许多有趣和多样化的应用。没有其他CRISPR工具能够如此精确地切割RNA。这又是一个很好的例子,说明这些基础生物学驱动的探索可以产生治疗和诊断的新工具。我们肯定还只是触及了自然多样性的表面。”
参考资料:
Ahsen Özcan et al. Programmable RNA targeting with the single-protein CRISPR effector Cas7-11. Nature, 2021, doi:10.1038/s41586-021-03886-5.