12月20日,国家药品监督管理局(NMPA)正式批准诺华开发的靶向CD20的全人源单克隆抗体全欣达(奥法妥木单抗)上市,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发缓解型多发性硬化和活动性继发进展型多发性硬化。这是诺华继捷灵亚(芬戈莫德)、万立能(西尼莫德)之后在中国推出的第3款治疗多发性硬化(MS)的药物,也是目前中国和全球首个且唯一一款可通过自感随心笔®每月一次居家自行管理的B细胞靶向疗法。
多发性硬化(MS)是一种以中枢神经系统炎性脱髓鞘病变为主要特点的免疫介导性疾病,表现出神经硬化斑块的病变特征以及多样化的复杂临床症状,包括反复发作的肢体无力、感觉异常、视力问题、膀胱或肠道功能异常、语言障碍、共济失调或认知能力损伤等。当神经损伤积累到一定程度,临床症状即不再出现缓解,病情随时间缓慢持续进展和恶化,最终可能会导致失明、残疾、丧失自理能力的严重后果。
在过去几十年里,针对不同的生物学信号通路,研究人员开发了多种疾病修正疗法(DMT)用于MS的临床治疗,以达到减少疾病复发频率,延缓患者残疾进展的目的。自1993年FDA批准拜耳的干扰素β-1b作为首款MS疾病修正疗法上市以来,全球已陆续批准21款药物,持续丰富和革新MS的治疗手段,药物降低MS复发的疗效已经从30%提高到了60%左右;给药方式上也从干扰素的频繁注射逐步升级到小分子药物口服、单抗药物静脉注射每6个月1次、皮下给药每个月1次,治疗的便利性持续提高,患者的生活质量得到极大改善。
中国近几年也加大了对MS患者临床治疗需求的政策支持力度,包括将MS列入罕见病目录,将芬戈莫德等3个创新口服疗法列入临床急需药品清单并以优先审评方式加速上市,将西尼莫德、芬戈莫德、特立氟胺纳入医保目录……,大大提高了MS创新药在国内的可及性。此次诺华推出上市的全欣达更是为中国MS患者开创了一种全新的疾病管理方式。
奥法妥木单抗:靶向CD20,诱导致病性B细胞溶解和消除
既往普遍认为MS是由CD4 + T细胞介导的自身免疫反应,只需要干预T细胞就能治疗MS。近年来发现,B细胞在MS的发病机制中发挥重要作用,是神经脱髓鞘的主要诱因[1]。MS患者活组织检查结果也显示,炎性活动性脱髓鞘病灶内有增加的B细胞数量和明显的抗体和补体沉积。
B细胞主要通过以下几种方式参与和促进MS的发病和进展:1)B细胞产生的针对自身抗原的反应性抗体以及浆细胞产生的脑脊液寡克隆区带(OCBs)导致鞘内免疫球蛋白失衡。2)B细胞作为抗原提呈细胞,摄取、加工外源性抗原,并以抗原肽—MHC II类分子复合物的形式将抗原肽提呈给CD4+ T细胞,导致T细胞活化。同时,T细胞又通过各种细胞因子辅助B细胞的增殖和分化。3)B细胞产生多种促炎介质,如白细胞介素6 ( IL-6 ) 、IL -12 、粒细胞集落刺激因子、肿瘤坏死因子α及淋巴毒素α等,促进T细胞的增殖和分化[1]。
CD20是一种细胞表面抗原,表达在前B细胞(Pre-B)、成熟B细胞和记忆B细胞上,但不表达在淋巴干细胞和浆细胞上。除在正常B细胞中表达外,CD20还在涉及免疫疾病和炎症疾病的B细胞、B细胞来源的淋巴瘤、白血病等的肿瘤细胞表达,因此CD20抗原是MS等免疫性疾病、淋巴癌、白血病等病种的有效治疗靶标。
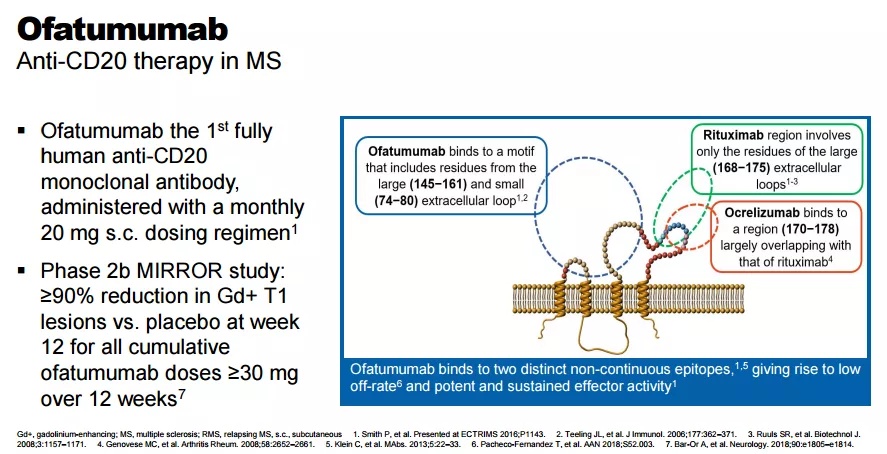
奥法妥木单抗是首个靶向CD20的全人源单克隆抗体,能够选择性与B细胞表面CD20抗原结合,通过抗体依赖的细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒性作用(CDC)诱导致病性B细胞溶解和消除。相比其他抗CD20抗体,奥法妥木单抗作为全人源单抗,减少了免疫原性,不会被人体抗体迅速清除,具有更高的生物利用度[2-3],同时可以特异性结合CD20的胞外大环和小环两个位点,因此较小剂量就可达到等效治疗浓度,具备了开发成皮下给药制剂的优势。
由于奥法妥木单抗只是选择性清除了表达CD20的B细胞亚群,而保留了祖B细胞和浆细胞,从而保留了B细胞的重建功能和浆细胞的免疫监视功能。临床前研究表明,除脾脏和淋巴结之外,皮下给药奥法妥木单抗和静脉注射其他抗CD20抗体在循环和主要器官达到相似水平[4]。低剂量皮下给药奥法妥木单抗治疗有效地消耗了血浆中B细胞,然而脾脏和淋巴结中滤泡B细胞和边缘区B细胞则不受影响,保留这部分B细胞储备了应对血源性感染的功能[5]。
强效便捷:年复发率降低近60%,脑部病灶清除98%,全年居家给药只需1分钟
两项代号为ASCLEPIOS I和ASCLEPIOSII的III期试验数据和一项代号为ALITHIOS的长达3.5年的开放标签扩展研究证明了奥法妥木单抗皮下给药的疗效和安全性。
ASCLEPIOS I和ASCLEPIOSII研究中,与每日1次口服特立氟胺14mg相比,每月1次皮下给药奥法妥木单抗可使患者的年复发率(ARR)降低近60%(ARR=0.1相当于患者每10年复发1次)[6]。

就远期结局来看,每月1次皮下给予奥法妥木单抗相比每日1次口服特立氟胺,可使3个月总体残疾进展(CDW)风险降低高达34%,使独立于复发的残疾进展风险降低高达41%。
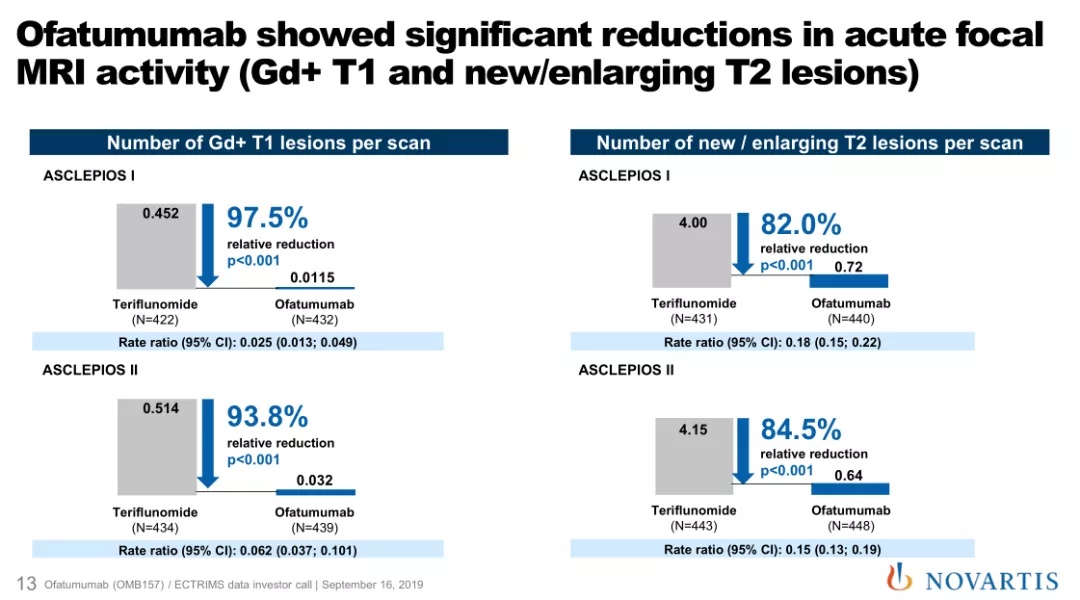
值得指出的是,奥法妥木单抗皮下给药治疗不仅可以实现感观上的复发率降低、残疾风险降低获益,更是能够在机体生理上获得病灶消除的器质性获益。ASCLEPIOS I研究的MRI扫描结果显示,奥法妥木单抗组钆增强(Gd+)T1病灶数量较于特立氟胺组减少高达98%;ASCLEPIOS II研究中,奥法妥木单抗组新增或扩大的T2病灶数量相比特立氟胺组减少85%,90%的患者在第2年没有出现疾病活动的证据(NEDA-3即没有复发、残疾进展和核磁影像病灶新增或扩大) [7]。由此可见,奥法妥木单抗相比标准疗法可以极大程度地抑制病灶活动。
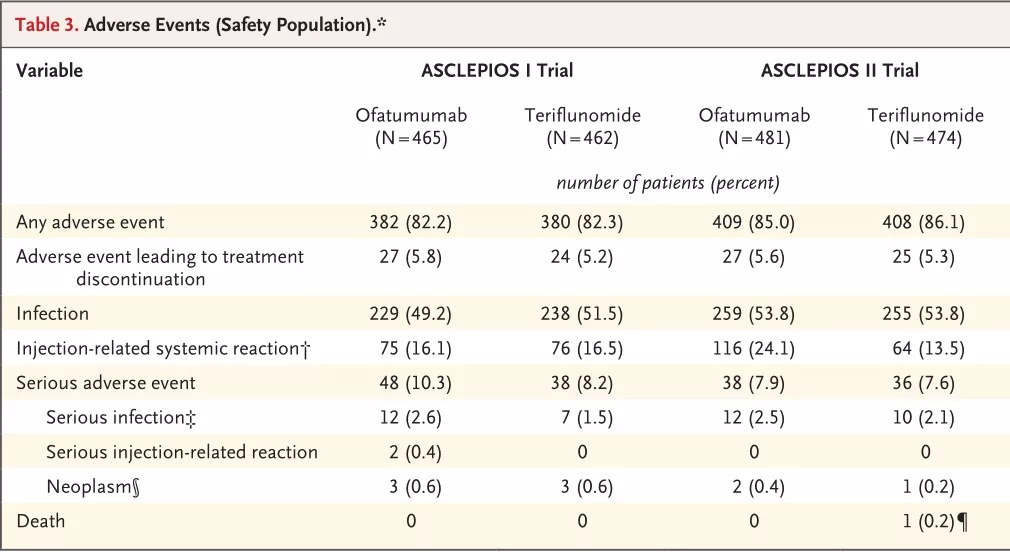
奥法妥木单抗皮下给药理论上的安全性优势在临床试验中也得到充分证明。在ASCLEPIOS I和ASCLEPIOS II 试验中,奥法妥木单抗组报告的感染、严重感染和注射相关感染与特立氟胺组报告的感染、严重感染、注射相关感染在数量上并无明显差异,不增加感染风险[7]。ALITHIOS研究长达3.5年的开放标签扩展试验也证明了奥法妥木单抗的安全性,数据显示奥法妥木单抗能长期维持 IgG 水平,感染总体发生率低。此外,相较传统口服DMT药物,单抗类药物无肝肾毒性,安全性更高。
更值得称道的地方在于,奥法妥木单抗皮下给药给患者开创了一种前所未有的便捷疾病管理方式。患者使用自感随心笔®在家中就能自行治疗,在完成前3周每周1次的起始治疗后,维持治疗期间每月只需1次,每次给药只要听到“咔、哒”两声便可完成,历时不超过5秒,相当于一年只需要1分钟就可居家轻松管理自己的疾病,大大减少了去医院就医和接受治疗的麻烦,显著降低了治疗的时间成本和心理负担,让日常工作和生活完全恢复正常,几乎不受疾病影响。基于出色的疗效、安全性和便捷性,奥法妥木单抗有望成为MS患者的首选治疗方案之一。
结语
多发性硬化早期症状不明显,进展缓慢,容易误诊漏诊,是青年人群最常见的非创伤性致残性疾病。作为该领域的领军企业,诺华持续革新MS治疗手段和疾病管理理念,在2010年推出全球首个MS口服疗法捷灵亚(芬戈莫德),满足了需要长期用药的MS患者对口服药物的强烈需求,同时也是全球首个针对10岁及以上儿童和青少年MS患者的口服疗法;在2019年推出全球首个能够对出现早期进展信号的多发性硬化患者实现神经修复、延缓残疾进展的口服药物万立能(西尼莫德);在2020年推出了首个皮下给药制剂全欣达(奥法妥木单抗),丰富患者治疗选择,改善患者生活质量。目前,诺华在MS领域拥有一个符合患者全病程管理需要的产品线,可满足初治复发缓解型MS、继发进展型和原发进展型MS的不同临床需求。
全球范围内针对MS的治疗新技术和新疗法方兴未艾。靶向药物方面,BTK抑制剂获得了成功的概念性验证数据,PPARγ调节剂、CD19单抗、CD40L单抗、BAFF单抗治疗MS的临床研究正在进行中,包括诺华司库奇尤单抗(IL-17A单抗)针对MS的开发也推进到了III期阶段。随着干细胞疗法、反义疗法、T细胞疗法、TCR疫苗等更加前沿的疗法不断拓展疾病应用领域,相信终有一天能够为MS患者带来逆转疾病进展和实现治愈的药物。
参考资料
[1] 张华,任桥桥. 利妥昔单抗在多发性硬化中研究进展. Journal of International Neurology and Neurosurgery 2019,46(4)
[2]. Immunoglobulins (IgA, IgG, IgM)—Understand the test & your results Merck Manual. Available at: https://www.merckmanuals.com/-/media/Manual/LabTests/ImmunoglobulinsIgAIgGIgM.Accessed June 22, 2021.
[3]. Furst, D.E., Serum immunoglobulins and risk of infection: how low can you go? Semin Arthritis Rheum, 2009. 39(1): p.18-29
[4].Migotto MA, Mardon K, Orian J, et al. Efficient Distribution of a Novel Zirconium-89 Labeled Anti-cd20 Antibody Following Subcutaneous and Intravenous Administration in Control and Experimental Autoimmune Encephalomyelitis-Variant Mice. Front Immunol. 2019 Oct18;10:2437. doi: 10.3389/fimmu.2019.02437. PMID: 31681317; PMCID: PMC6813232.
[5].Theil D, Smith P, Huck C, et al. Imaging Mass Cytometry and Single-Cell Genomics Reveal Differential Depletion and Repletion of B-Cell Populations Following OfatumumabTreatment in Cynomolgus Monkeys. Front Immunol. 2019 Jun 20;10:1340. doi:10.3389/fimmu.2019.01340. PMID: 31281311; PMCID: PMC6596277.
[6]Ofatumumab (OMB157) / ECTRIMS Data Investor Call https://www.novartis.com/sites/www.novartis.com/files/2019-09-novartis-ectrims-investor-call-presentation.pdf
[7]. Hauser, S.L., et al., Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med, 2020. 383(6): p.546-557.